Hvorfor er metan eksoterm?
Her er hvorfor:
* eksotermiske reaktioner Slip energi i omgivelserne, normalt som varme.
* forbrænding er en kemisk reaktion, hvor et stof reagerer hurtigt med en oxidant, typisk ilt, for at producere varme og lys.
Forbrænding af methan (CH4) med ilt (O2) producerer kuldioxid (CO2) og vand (H2O) sammen med varme og lys:
CH4 + 2O2 → CO2 + 2H2O + varme + lys
Her er nedbrydningen af, hvorfor denne reaktion er eksoterm:
* Bond Breaking: At bryde bindingerne i metan og ilt kræver energi.
* obligationsdannelse: Danner bindingerne i kuldioxid og vand frigiver energi.
* Energibalance: Den energi, der frigives under bindingsdannelse i produkterne, er større end den energi, der kræves for at bryde bindingerne i reaktanterne. Denne forskel i energi frigøres som varme, hvilket gør reaktionen eksoterm.
Derfor er metan i sig selv ikke eksoterm. Den eksoterme reaktion er forbrænding af metan, hvor den energi, der frigives ved at danne nye bindinger, er større end den energi, der kræves for at bryde eksisterende bindinger.
Sidste artikelEr bilmaling en kemisk egenskab?
Næste artikelHvorfor danner gruppe 4 -metaller ioner?
 Varme artikler
Varme artikler
-
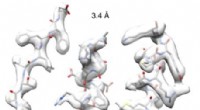 Kryo-EM-billeder i høj opløsning fra Afrika baner vejen for skræddersyede nitrilaser til industri…Ved at maskere en enkelt spiralformet drejning og behandle dette som en enkelt partikel, forskerne var i stand til at forbedre opløsningen væsentligt. Kredit:Diamond lyskilde Et team fra Cape Town
Kryo-EM-billeder i høj opløsning fra Afrika baner vejen for skræddersyede nitrilaser til industri…Ved at maskere en enkelt spiralformet drejning og behandle dette som en enkelt partikel, forskerne var i stand til at forbedre opløsningen væsentligt. Kredit:Diamond lyskilde Et team fra Cape Town -
 Plast glukose-drevet biosensor finder sød succesEt skematisk billede af biobrændselscellen i helt polymer, som trækker energi fra den glukose, der naturligt findes i spyt. Kredit:© 2019 KAUST; Heno Hwang En elektronisk biosensor drevet af gluko
Plast glukose-drevet biosensor finder sød succesEt skematisk billede af biobrændselscellen i helt polymer, som trækker energi fra den glukose, der naturligt findes i spyt. Kredit:© 2019 KAUST; Heno Hwang En elektronisk biosensor drevet af gluko -
 Forskere undersøger komplekse molekylære strukturerMolekylerne er blevet analyseret ved forskellige tryk (fra ultrahøjt vakuum til atmosfærisk tryk) Kredit:TU Wien Arbejdet med hæmoglobin ser ud til at være ret simpelt:Det transporterer iltmolekyl
Forskere undersøger komplekse molekylære strukturerMolekylerne er blevet analyseret ved forskellige tryk (fra ultrahøjt vakuum til atmosfærisk tryk) Kredit:TU Wien Arbejdet med hæmoglobin ser ud til at være ret simpelt:Det transporterer iltmolekyl -
 Grønt vandrensningssystem fungerer uden tungmetaller eller ætsende kemikalierDette billede viser en koncentrator, hvor prøver blev placeret. Kredit:Dan Wang Forskere ved Institute of Process Engineering (IPE) ved det kinesiske videnskabsakademi i Beijing og Yangzhou Univer
Grønt vandrensningssystem fungerer uden tungmetaller eller ætsende kemikalierDette billede viser en koncentrator, hvor prøver blev placeret. Kredit:Dan Wang Forskere ved Institute of Process Engineering (IPE) ved det kinesiske videnskabsakademi i Beijing og Yangzhou Univer
- Galaksehoben Abell 959
- Hvordan en virksomheds konsekvente indtjening kan få en CEO fyret
- Biolog opfordrer til beskyttelse og flere undersøgelser af naturlige tidskapsler af klimaændringer…
- Regnmængden bliver mere og mere varierende, efterhånden som klimaet opvarmes
- Spektrale linjer produceret fra den strålende energi, der udsendes ophidsede atomer, menes at være…
- Sådan passerer du FTCE Math


