Hvorfor opløses ammoniak lettere i vand end methanol?
1. Hydrogenbinding:
* ammoniak: Ammoniak danner stærke brintbindinger med vandmolekyler. Nitrogenatomet i ammoniak har et ensomt par elektroner, der kan danne brintbindinger med hydrogenatomerne i vand.
* methanol: Methanol danner også brintbindinger med vand, men disse bindinger er svagere end dem, der er dannet af ammoniak. Dette skyldes, at iltatomet i methanol er mindre elektronegativ end nitrogenatomet i ammoniak, hvilket fører til et svagere dipolmoment og svagere brintbindinger.
2. Polaritet:
* ammoniak: Ammoniak er et polært molekyle på grund af elektronegativitetsforskellen mellem nitrogen og brintatomer. Denne polaritet tillader ammoniak at interagere positivt med de polære vandmolekyler.
* methanol: Methanol er også et polært molekyle, men dens polaritet er mindre udtalt end ammoniak.
3. Molekylær størrelse:
* ammoniak: Ammoniak er et mindre molekyle end methanol. Denne mindre størrelse tillader ammoniak at interagere tættere med vandmolekyler, hvilket øger styrken af de intermolekylære kræfter.
4. Intermolekylære kræfter:
* ammoniak: De stærke hydrogenbindinger og dipol-dipolinteraktioner mellem ammoniak og vandmolekyler resulterer i en højere entalpi af opløsning til ammoniak sammenlignet med methanol. Dette betyder, at mere energi frigøres, når ammoniak opløses i vand, hvilket gør processen mere gunstig.
* methanol: Mens methanol danner brintbindinger med vand, er styrken af disse bindinger svagere end dem, der er dannet af ammoniak. Dette resulterer i en lavere entalpi af opløsning for methanol, hvilket gør den mindre opløselig i vand.
Kortfattet: Kombinationen af stærk hydrogenbinding, højere polaritet, mindre størrelse og højere entalpi af opløsning gør ammoniak markant mere opløselig i vand end methanol.
Sidste artikelHvilken gruppe af metaller er meget reaktiv?
Næste artikelHvad opleves den stress af en kemiker?
 Varme artikler
Varme artikler
-
 Gennem tykt og tyndt:Neutroner sporer lithium-ioner i batterielektroderKemiingeniørforskere fra University of Virginia School of Engineering anvender neutronbilleddannelse ved Oak Ridge National Laboratory til at undersøge lithium-ion-batterimaterialer og -strukturer. Kr
Gennem tykt og tyndt:Neutroner sporer lithium-ioner i batterielektroderKemiingeniørforskere fra University of Virginia School of Engineering anvender neutronbilleddannelse ved Oak Ridge National Laboratory til at undersøge lithium-ion-batterimaterialer og -strukturer. Kr -
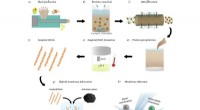 Dekontaminering af tungmetalvand ved hjælp af protein fra planteaffaldSkematisk over procesflow fra plantefrø til den amyloidbaserede filtreringsmembran. a) Fremstilling af solsikke- og jordnøddemel ved skruepresning af frø. b) Vandig proteinekstraktion af måltider (bru
Dekontaminering af tungmetalvand ved hjælp af protein fra planteaffaldSkematisk over procesflow fra plantefrø til den amyloidbaserede filtreringsmembran. a) Fremstilling af solsikke- og jordnøddemel ved skruepresning af frø. b) Vandig proteinekstraktion af måltider (bru -
 Forskydningskraft:Hvor gode materialer bliver gjort bedreMaterialeforskerne Arun Devaraj og Bharat Gwalani (forgrunden) bruger et pin-on-disk tribometer til at give forskydningsdeformation i materialer. Kredit:Arun Devaraj | Pacific Northwest National Labor
Forskydningskraft:Hvor gode materialer bliver gjort bedreMaterialeforskerne Arun Devaraj og Bharat Gwalani (forgrunden) bruger et pin-on-disk tribometer til at give forskydningsdeformation i materialer. Kredit:Arun Devaraj | Pacific Northwest National Labor -
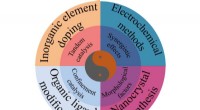 Tuningstrategier og struktureffekter af elektrokatalysatorer til kuldioxidreduktionsreaktionenForskellige afstemningsstrategier muliggør forskelle i katalysatorstrukturer. Hvordan træffer man et valg fra disse tilgængelige tuning-strategier? Der kan foretages en afvejning mellem den ønskede st
Tuningstrategier og struktureffekter af elektrokatalysatorer til kuldioxidreduktionsreaktionenForskellige afstemningsstrategier muliggør forskelle i katalysatorstrukturer. Hvordan træffer man et valg fra disse tilgængelige tuning-strategier? Der kan foretages en afvejning mellem den ønskede st
- Med alle fastklemt indendørs, esport er klar til tid i solen
- Hvordan fungerer strukturen af makromolekyler, såsom proteiner, en indeksrelateret mellem art?
- De bedste spioner i himlen analyserer Mellaria
- Eneboer eller ej? Forskere bruger Twitter til at løse edderkoppespørgsmål
- Hvad forårsagede hullerne i SUE T. rex' kæbe? Sandsynligvis ikke en infektion
- Arktis har ikke været så varmt i 3 millioner år - og det varsler store ændringer for resten af …


