Hvilken gruppe af metaller er meget reaktiv?
Her er hvorfor:
* placering på den periodiske tabel: Alkalimetaller findes i gruppe 1 i den periodiske tabel.
* Elektronkonfiguration: De har kun en valenselektron, som de let mister for at danne en +1 -kation. Dette gør dem meget ivrige efter at reagere med andre elementer.
* reaktivitetstendenser: Når du bevæger dig ned ad gruppen, øges reaktiviteten af alkalimetaller. Dette skyldes, at den yderste elektron er længere væk fra kernen og lettere fjernet.
Eksempler på alkalimetaller inkluderer:
* Lithium (Li)
* Natrium (NA)
* Kalium (k)
* Rubidium (RB)
* Cesium (CS)
* Francium (FR)
Disse metaller reagerer voldsomt med vand, ilt og andre ikke -metaller. De opbevares typisk under olie for at forhindre dem i at reagere med luften.
Sidste artikelHvordan ser flydende jernchlorid ud?
Næste artikelHvorfor opløses ammoniak lettere i vand end methanol?
 Varme artikler
Varme artikler
-
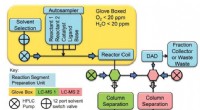 Flowapparater prøver op til 1500 kemiske reaktioner om dagenSkematisk afbildning af flowsystemet. Kredit: Videnskab (2018). DOI:10.1126/science.aap9112 Et team af forskere på Pfizer, medicinalgiganten, har udviklet et automatiseret flowkemisystem, der er
Flowapparater prøver op til 1500 kemiske reaktioner om dagenSkematisk afbildning af flowsystemet. Kredit: Videnskab (2018). DOI:10.1126/science.aap9112 Et team af forskere på Pfizer, medicinalgiganten, har udviklet et automatiseret flowkemisystem, der er -
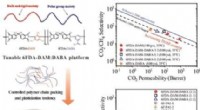 Polyimidmembraner til rensning af naturgasKredit:Wiley Naturgas, der indeholder større mængder hydrogensulfid (H 2 S) og kuldioxid (CO 2 ) kaldes sur gas. Før det kan komme ind i en pipeline, det skal sødes ved at fjerne dets sure ure
Polyimidmembraner til rensning af naturgasKredit:Wiley Naturgas, der indeholder større mængder hydrogensulfid (H 2 S) og kuldioxid (CO 2 ) kaldes sur gas. Før det kan komme ind i en pipeline, det skal sødes ved at fjerne dets sure ure -
 Magnetiske tænder afsløret ved hjælp af kvantebillederAcanthopleura hirtosa chiton radula. Den fulde radula består af 73 tænder med forskellige stadier af mineralisering. Billedet ovenfor viser tænderne før og efter starten af magnetitmineralisering. D
Magnetiske tænder afsløret ved hjælp af kvantebillederAcanthopleura hirtosa chiton radula. Den fulde radula består af 73 tænder med forskellige stadier af mineralisering. Billedet ovenfor viser tænderne før og efter starten af magnetitmineralisering. D -
 Kræft målrettet med genanvendelig brændenældebehandlingRepræsentation af den organiske osmiumforbindelse, som udløses ved hjælp af en ikke-toksisk dosis natriumformiat, et naturligt produkt, der findes i mange organismer, herunder brændenælder og myrer. K
Kræft målrettet med genanvendelig brændenældebehandlingRepræsentation af den organiske osmiumforbindelse, som udløses ved hjælp af en ikke-toksisk dosis natriumformiat, et naturligt produkt, der findes i mange organismer, herunder brændenælder og myrer. K
- Den globale vejafgift fra jordskred er tungest i udviklingslandene
- Sjældent jordskælv med en styrke på 5,4 rammer det sydlige S. Korea (opdatering)
- Thyssenkrupp står over for aggressiv omstrukturering, efter at chefer stopper (opdatering)
- Ny rapport hævder brudt system svigter migrantarbejdere, der lider af løntyveri
- Hvilke typer stjerner er usynlige?
- Hvorfor producerer solen ikke en jernkerne i midten, som den gjorde i andre solsystemlegemer?


