Hvad er to egenskaber ved en ideel gas, der ikke sandt er en rigtig gas?
1. ideelle gasmolekyler har ingen volumen. Ægte gasmolekyler har en endelig størrelse. Dette betyder, at molekylerne i en reel gas optager i sig selv noget af pladsen i beholderen, og dette volumen kan ikke ignoreres ved højt tryk.
2. ideelle gasmolekyler har ingen intermolekylære kræfter. Ægte gasmolekyler oplever attraktive kræfter mellem dem (som van der Waals Forces). Disse kræfter får molekylerne til at afvige fra den ideelle gasadfærd, især ved lave temperaturer og høje tryk, hvor molekylerne er tættere sammen, og kræfterne bliver mere markante.
 Varme artikler
Varme artikler
-
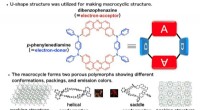 Unikke organiske lys-emitterende molekylære emittereFig. 1 Skematisk forklaring af det udviklede TADF-aktive makrocykliske materiale. Kredit:Osaka University Et hold med forskere fra Osaka University har produceret en ny molekylær emitter til organ
Unikke organiske lys-emitterende molekylære emittereFig. 1 Skematisk forklaring af det udviklede TADF-aktive makrocykliske materiale. Kredit:Osaka University Et hold med forskere fra Osaka University har produceret en ny molekylær emitter til organ -
 Nanodiamanter som fotokatalysatorerDopet diamantskum. Kredit:P. Knittel/Fraunhofer IAF Klimaændringerne er i fuld gang og vil fortsætte uformindsket, så længe CO 2 emissioner fortsætter. En mulig løsning er at returnere CO 2 ti
Nanodiamanter som fotokatalysatorerDopet diamantskum. Kredit:P. Knittel/Fraunhofer IAF Klimaændringerne er i fuld gang og vil fortsætte uformindsket, så længe CO 2 emissioner fortsætter. En mulig løsning er at returnere CO 2 ti -
 Video:Hvordan tåregas påvirker din kropKredit:The American Chemical Society 2-chlorbenzalmalononitril, bedre kendt som CS-gas, er en af de mest almindelige tåregasser, der bruges i USA i dag, men vidste du, at det faktisk ikke er en
Video:Hvordan tåregas påvirker din kropKredit:The American Chemical Society 2-chlorbenzalmalononitril, bedre kendt som CS-gas, er en af de mest almindelige tåregasser, der bruges i USA i dag, men vidste du, at det faktisk ikke er en -
 Forskere analyserer struktur, mekanisme for fagprotein, der stjæler elektronerRisforskere analyserer rollen som ferredoxinproteiner, der produceres, når virale fager ændrer elektronoverførsel i havets bolig, fotosyntetiske bakterier, der producerer ilt og lagrer kulstof. Når vi
Forskere analyserer struktur, mekanisme for fagprotein, der stjæler elektronerRisforskere analyserer rollen som ferredoxinproteiner, der produceres, når virale fager ændrer elektronoverførsel i havets bolig, fotosyntetiske bakterier, der producerer ilt og lagrer kulstof. Når vi
- Hvordan fungerer et remskivesystem?
- Flere kvinder rapporterer at føle sig utrygge på offentlig transport siden #MeToo-bevægelsen
- En galakse med en bule i midten og spiralarme?
- Hvor mange nitrogenatomer og hvor brint er der i et molekyle af NH?
- Elementer af et økosystem
- Vægte, der bruges til at måle jordskælv


