Hvad er pH af ZnnO32?
Forstå zinknitrat og pH
* zinknitrat (Zn (no₃) ₂) er et salt. Saltene dannes ud fra reaktionen af en syre og en base.
* salte kan være sure, basale eller neutrale. PH af en saltopløsning afhænger af styrken af den syre og base, der dannede den.
Bestemmelse af pH af zinknitratopløsning
1.
* Zn (no₃) ₂ dannes ved reaktionen af zinkhydroxid (Zn (OH) ₂) og salpetersyre (HNO₃) .
2. Bestem styrkerne ved syren og basen:
* salpetersyre (HNO₃) er en stærk syre. Stærke syrer ioniserer i vand.
* zinkhydroxid (Zn (OH) ₂) er en svag base. Svage baser ioniser kun delvist i vand.
3. Analyser saltens reaktion med vand:
* Når Zn (no₃) ₂ opløses i vand, danner det Zn²⁺ og ingen ioner.
* No₃⁻ionerne kommer fra en stærk syre (HNO₃) og reagerer ikke med vand.
* Zn²⁺ionerne kommer fra en svag base (Zn (OH) ₂) og reagerer lidt med vand for at danne nogle H⁺ioner.
4. Konklusion:
* Da Zn²⁺ -ionerne reagerer med vand for at producere en lille mængde H⁺, vil opløsningen være lidt sur.
* Den nøjagtige pH afhænger af koncentrationen af Zn (NO₃) ₂ -opløsningen.
I resuméet vil en opløsning af Zn (NO₃) ₂ være let sur på grund af hydrolysen af Zn²⁺ionerne. PH vil være lidt lavere end 7.
Vigtig note: For at beregne den nøjagtige pH -værdi skal du bruge ligevægtskonstanten til hydrolyse -reaktionen af Zn²⁺.
 Varme artikler
Varme artikler
-
 Hydrogel kontrollerer cellevækst uden for kroppenKredit:CC0 Public Domain Kemikere ved Radboud Universitet opdagede et unikt materiale i 2013. Fra en syntetisk polymer ved navn polyisocyanopeptid (PIC), de lavede en gel, der opfører sig som den
Hydrogel kontrollerer cellevækst uden for kroppenKredit:CC0 Public Domain Kemikere ved Radboud Universitet opdagede et unikt materiale i 2013. Fra en syntetisk polymer ved navn polyisocyanopeptid (PIC), de lavede en gel, der opfører sig som den -
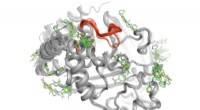 Forskere opdager en måde at kigge inde i proteiner for at se, hvordan de er forbundetEn high-throughput-metode afslører, hvor over 100 små molekyler binder til proteinet PTP1B. Nogle få af disse bindingsområder kan sende signaler til det aktive sted (rødt) for at kontrollere PTP1Bs ak
Forskere opdager en måde at kigge inde i proteiner for at se, hvordan de er forbundetEn high-throughput-metode afslører, hvor over 100 små molekyler binder til proteinet PTP1B. Nogle få af disse bindingsområder kan sende signaler til det aktive sted (rødt) for at kontrollere PTP1Bs ak -
 Kunstig fotosyntese kan omdanne ubrugelig kuldioxid til myresyre, der bruges i industrienNaturlig fotosyntese er ikke altid særlig effektiv. Når videnskabsmænd efterligner det, de forsøger at gøre processerne meget mere effektive. Kredit:Colourbox Med energi fra solen, et særligt enzy
Kunstig fotosyntese kan omdanne ubrugelig kuldioxid til myresyre, der bruges i industrienNaturlig fotosyntese er ikke altid særlig effektiv. Når videnskabsmænd efterligner det, de forsøger at gøre processerne meget mere effektive. Kredit:Colourbox Med energi fra solen, et særligt enzy -
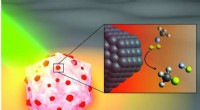 Team afslører katalysator, der kan bryde problematiske C-F-bindingerEn kunstners illustration af den lysaktiverede antenne-reaktor-katalysator Rice University-ingeniører designet til at bryde kulstof-fluor-bindinger i fluorcarboner. Aluminiumsdelen af partiklen (hvi
Team afslører katalysator, der kan bryde problematiske C-F-bindingerEn kunstners illustration af den lysaktiverede antenne-reaktor-katalysator Rice University-ingeniører designet til at bryde kulstof-fluor-bindinger i fluorcarboner. Aluminiumsdelen af partiklen (hvi
- Ny teknologi giver elektrificerende indsigt i, hvordan katalysatorer fungerer på atomniveau
- Hvor høj er Dome -bjerget?
- Hvorfor virker vand som opløsningsmiddel af ioniske forbindelser?
- Hvor kan du finde de magellanske skyer?
- Argonspray bevarer rester af flaskevin
- Holdet studerer, hvordan egoistiske gener forårsager mandlig sterilitet i blomstrende planter


