Hvorfor er dioxygen en gas og svovl fast?
Her er en sammenbrud:
* dioxygen (O 2 )
* lille størrelse: Oxygenatomer er relativt små.
* svage intermolekylære kræfter: O 2 Molekyler er ikke -polære og udviser kun svage London -spredningskræfter (van der Waals -styrker) mellem dem.
* lav molekylvægt: Molekylvægten af O 2 er 32 g/mol.
Disse faktorer kombineres for at betyde, at dioxygenmolekyler har lave attraktive kræfter og let kan bevæge sig rundt, hvilket gør det til en gas ved stuetemperatur.
* svovl (r)
* Større størrelse: Svovlatomer er større end iltatomer.
* stærkere intermolekylære kræfter: Elementær svovl findes som S 8 Molekyler (otte svovlatomer deltog i en ring) og udviser stærkere London -spredningskræfter på grund af deres større størrelse og større polariserbarhed.
* Højere molekylvægt: Molekylvægten af S 8 er 256 g/mol.
Kombinationen af disse faktorer resulterer i stærkere intermolekylære kræfter og en mere kompakt struktur, hvilket gør svovl til et fast stof ved stuetemperatur.
Kortfattet:
* dioxygen (O 2 ): Lille størrelse, svage kræfter, lav molekylvægt => gas ved stuetemperatur.
* svovl (s 8 ): Større størrelse, stærkere kræfter, høj molekylvægt => fast ved stuetemperatur.
 Varme artikler
Varme artikler
-
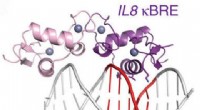 Duel af de inflammatoriske masterregulatorer – indsigt til lægemiddelopdagelseFigur:Diagram over glukokortikoidreceptoren, der binder et NF-kappaB-sted. Kredit:Hudson et al. Naturkommunikation (2018). Anti-inflammatoriske lægemidler såsom dexamethason kan have skadelige biv
Duel af de inflammatoriske masterregulatorer – indsigt til lægemiddelopdagelseFigur:Diagram over glukokortikoidreceptoren, der binder et NF-kappaB-sted. Kredit:Hudson et al. Naturkommunikation (2018). Anti-inflammatoriske lægemidler såsom dexamethason kan have skadelige biv -
 Ny indsigt i nanokrystalvækst i væskeGlimmer mineralet flager af i fine plader. Kredit:Wikimedia Commons Mange muslingeskaller, mineraler, og halvleder nanomaterialer er opbygget af mindre krystaller, som er samlet som brikkerne i et
Ny indsigt i nanokrystalvækst i væskeGlimmer mineralet flager af i fine plader. Kredit:Wikimedia Commons Mange muslingeskaller, mineraler, og halvleder nanomaterialer er opbygget af mindre krystaller, som er samlet som brikkerne i et -
 Spray-on elektriske regnbuer:Fremstilling af sikrere elektrokromisk blækPrøver viser nogle af de farver, forskere har produceret i elektrokrome polymerer. Materialerne kan bruges til anvendelser såsom solbriller og rudefarvning, der kan tændes og slukkes ved påføring af e
Spray-on elektriske regnbuer:Fremstilling af sikrere elektrokromisk blækPrøver viser nogle af de farver, forskere har produceret i elektrokrome polymerer. Materialerne kan bruges til anvendelser såsom solbriller og rudefarvning, der kan tændes og slukkes ved påføring af e -
 Superdiamond carbon-bor bure kan fange og udnytte forskellige egenskaberKlatratstrukturen af todelt sodalit-type, som består af trunkerede oktaedriske værts-bure, der fanger strontium-gæste-atomer, blev syntetiseret under højtryks- og højtemperaturforhold ved hjælp af e
Superdiamond carbon-bor bure kan fange og udnytte forskellige egenskaberKlatratstrukturen af todelt sodalit-type, som består af trunkerede oktaedriske værts-bure, der fanger strontium-gæste-atomer, blev syntetiseret under højtryks- og højtemperaturforhold ved hjælp af e
- Hvordan påvirker breddegrad og højde klimaet i ørkenen?
- Optrævling af en væsentlig årsag til havisens tilbagetrækning i det arktiske hav
- Er solen større end sorte huller?
- Kemikere viser, at 18-elektronprincippet ikke er begrænset til overgangsmetaller
- Er trækul mindre tæt end vand?
- Hvordan påvirker svampetoksiner mennesker?


