Hvor mange gram H2 er der behov for for at reducere 5,51 mol Cuo i reaktionen?
1. Afbalanceret kemisk ligning:
Reaktionen mellem kobberoxid (CuO) og brintgas (H₂) er:
Cuo + H₂ → Cu + H₂O
2. Molforhold:
Fra den afbalancerede ligning ser vi, at 1 mol H₂ reagerer med 1 mol Cuo.
3. Beregning:
Da vi har 5,51 mol Cuo, har vi brug for en lige stor mængde H₂ for at reagere fuldstændigt.
Derfor har vi brug for 5,51 mol H₂ .
4. Konverter mol til gram:
For at konvertere mol H₂ til gram bruger vi den molære masse af H₂ (2,016 g/mol).
Masse af H₂ =(5,51 mol H₂) * (2,016 g/mol) = 11,1 g H₂
Svar: Du har brug for 11,1 gram H₂ At reducere 5,51 mol Cuo.
 Varme artikler
Varme artikler
-
 Blanding af kunstige sødestoffer hæmmer bitter smagsreceptorerKredit:CC0 Public Domain Blandinger af kunstige sødestoffer som saccharin og cyclamat giver mindre bitter bismag end hver af de individuelle komponenter, men forklaringen på dette forvirrende fæno
Blanding af kunstige sødestoffer hæmmer bitter smagsreceptorerKredit:CC0 Public Domain Blandinger af kunstige sødestoffer som saccharin og cyclamat giver mindre bitter bismag end hver af de individuelle komponenter, men forklaringen på dette forvirrende fæno -
 Fotokatalytisk generering af meget reaktive alkyner under synlige lysforholdDen første fotokatalytiske aktive alkyngenerering fra en cyclopropenon under synlige lysforhold er blevet opnået. De genererede aktive alkyner såsom ynamin og cyclooctyne kan anvendes direkte, uden is
Fotokatalytisk generering af meget reaktive alkyner under synlige lysforholdDen første fotokatalytiske aktive alkyngenerering fra en cyclopropenon under synlige lysforhold er blevet opnået. De genererede aktive alkyner såsom ynamin og cyclooctyne kan anvendes direkte, uden is -
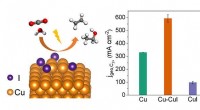 Ny katalysator øger kuldioxid elektroreduktion til multicarbon-produkterEn Cu-CuI-kompositkatalysator opnår højeffektiv produktion af C 2 + kemikalier fra elektrokatalytisk CO 2 reduktion. Kredit:LI Hefei og LIU Tianfu Elektrokatalytisk CO 2 reduktionsreaktion
Ny katalysator øger kuldioxid elektroreduktion til multicarbon-produkterEn Cu-CuI-kompositkatalysator opnår højeffektiv produktion af C 2 + kemikalier fra elektrokatalytisk CO 2 reduktion. Kredit:LI Hefei og LIU Tianfu Elektrokatalytisk CO 2 reduktionsreaktion -
 Bryde molekylære trafikpropper med finnede nanoporøse materialer3D-finnede zeolitkatalysatorer forbedrer molekyladgang til det indre af partiklen. Kredit:J.C. Palmer Tusindvis af kemiske processer, der bruges af energiindustrien og til andre anvendelser, er af
Bryde molekylære trafikpropper med finnede nanoporøse materialer3D-finnede zeolitkatalysatorer forbedrer molekyladgang til det indre af partiklen. Kredit:J.C. Palmer Tusindvis af kemiske processer, der bruges af energiindustrien og til andre anvendelser, er af
- Hvilken overførsel af varme ved bevægelsen luftstrømme i jordens atmosfære er et eksempel på?
- Sådan reparerer zebrafisken et knust hjerte
- Hvor mange mol mgcl2 er der i 313 g forbindelsen?
- Når elektronik krymper til nanoskala, vil de så stadig være gode som guld?
- Sådan fungerer stealth bombefly
- Sydafrikas Naspers indkasserer $10 mia. Tencents indsats


