Hvad sker der i en Brønsted-Lowry Acid-base-reaktion?
1. Protonoverførsel:
* A Brønsted-Lowry Acid er en art, der donerer En proton (H⁺).
* A Brønsted-Lowry Base er en art, der accepterer en proton.
2. Konjugatpar:
* Når en syre mister en proton, danner den sin konjugatbase .
* Når en base får en proton, danner den sin konjugatsyre .
3. Ligevægt:
* Brønsted-lowry-reaktioner er reversible og nå en ligevægt . Dette betyder, at reaktionen kan fortsætte i begge retninger, hvor syren donerer en proton og basen accepterer en proton eller omvendt.
Her er en forenklet forklaring:
Forestil dig en trækkraft mellem to hold:
* teamsyre Holder en proton.
* teambase ønsker protonen.
Når teambase Vinder, syren har doneret sin proton og bliver den konjugerede base. Basen accepterer protonen og bliver konjugatsyren.
Eksempel:
* HCL (syre) + H₂O (base) ⇌ H₃O⁺ (Conjugate Acid) + Cl⁻ (Conjugate Base)
I dette eksempel donerer HCL en proton til vand og danner hydroniumion (H₃O⁺) og chloridion (CL⁻).
Nøglepunkter:
* Styrken af en syre eller base bestemmes af dens evne til at donere eller acceptere protoner.
* Stærke syrer donerer let protoner, mens stærke baser let accepterer protoner.
* Ligevægtspositionen i en Brønsted-Lowry-reaktion indikerer de relative styrker af den involverede syre og basen.
* Brønsted-lowry-teori hjælper med at forklare opførslen af syrer og baser i forskellige reaktioner, herunder neutralisering, pufferopløsninger og syre-base-titreringer.
 Varme artikler
Varme artikler
-
 Forskere observerer individuelle cellulære receptorer på arbejdeSamtidig visualisering og sporing af individuelle receptorer (grøn) og G -proteiner (magenta) på overfladen af en levende celle. Receptorerne og G -proteiner gennemgår forbigående interaktioner, som
Forskere observerer individuelle cellulære receptorer på arbejdeSamtidig visualisering og sporing af individuelle receptorer (grøn) og G -proteiner (magenta) på overfladen af en levende celle. Receptorerne og G -proteiner gennemgår forbigående interaktioner, som -
 Pharma sigter mod at lave en bedre CBDKredit:CC0 Public Domain Cannabidiol (CBD) er en stadig mere populær wellness-trend. Sammensætningen, som forekommer naturligt i cannabisplanter, er tilføjet til mange produkter, der hævder at red
Pharma sigter mod at lave en bedre CBDKredit:CC0 Public Domain Cannabidiol (CBD) er en stadig mere populær wellness-trend. Sammensætningen, som forekommer naturligt i cannabisplanter, er tilføjet til mange produkter, der hævder at red -
 NIST præsenterer den første test i den virkelige verden af nye designs til røggasemissionerNIST designet to nye pitotprober (venstre og i midten), den ene, hvis sanseflade er kegleformet, og den anden, hvis overflade er halvkugleformet. Proberne har fem huller, eller havne. Sammenligning af
NIST præsenterer den første test i den virkelige verden af nye designs til røggasemissionerNIST designet to nye pitotprober (venstre og i midten), den ene, hvis sanseflade er kegleformet, og den anden, hvis overflade er halvkugleformet. Proberne har fem huller, eller havne. Sammenligning af -
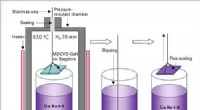 Udvikling af en ny teknik til dyrkning af højkvalitets galliumnitridkrystallerFigur 1. Skematisk af GaN-krystalvækstteknikken ved anvendelse af Flux-Film-Coated Liquid Phase Epitaxy (FFC-LPE) teknikken. Kredit:National Institute for Materials Science Galliumnitridkrystaller
Udvikling af en ny teknik til dyrkning af højkvalitets galliumnitridkrystallerFigur 1. Skematisk af GaN-krystalvækstteknikken ved anvendelse af Flux-Film-Coated Liquid Phase Epitaxy (FFC-LPE) teknikken. Kredit:National Institute for Materials Science Galliumnitridkrystaller
- Hvad gør egentlig avocadoer dårlige for miljøet?
- Gruppeprojekt? På skift arbejde med venner kan forbedre karakterer
- Hvordan kunstig intelligens og big data kan hjælpe med at bevare dyrelivet
- Sådan beregnes opløselighed fra KSP
- Hvad fortsatte Aristoteles med videnskaben?
- Hvad er bedre et Yosco -teleskop eller en saksisk novo 705az3 refraktorteleskop?


