Hvorfor placeres brint i den første gruppe, hvis det er et ikke -metal?
* Elektronkonfiguration: Hydrogen har kun en elektron, ligesom alkalimetaller i gruppe 1.. Denne enkelt elektron optager sin 1s orbital, svarende til lithium, natrium osv. Denne delte elektronkonfiguration er, hvorfor brint ofte opfører sig som et metal i kemiske reaktioner.
* reaktivitet: Hydrogen kan miste sin elektron og danne en positiv ion (H+), svarende til alkalimetaller. Dette gør det muligt for det at danne ioniske forbindelser som HCI (saltsyre).
* Fysiske egenskaber: Mens brint er en gas ved stuetemperatur, deler den ikke de metalliske egenskaber af alkalimetaller.
Dilemmaet:
Hydrogen udviser nogle egenskaber ved både metaller og ikke -metaller. Dette gør sin placering udfordrende.
* gruppe 1: Dens elektronkonfiguration og evne til at danne ioniske forbindelser får den undertiden til at passe med alkalimetaller.
* gruppe 17: Hydrogen kan også få et elektron til dannelse af hydridion (H-), svarende til halogener.
Løsningen:
Hydrogen er ofte placeret øverst i gruppe 1, men det er vigtigt at huske, at det er et specielt tilfælde. Det præsenteres undertiden separat fra resten af tabellen eller placeret over både grupper 1 og 17 for at fremhæve dens unikke natur.
Fortæl mig, hvis du har andre spørgsmål!
Sidste artikelHvad betyder det, der består af atomer?
Næste artikelEr metalloider de bedste ledere af varme og elektricitet?
 Varme artikler
Varme artikler
-
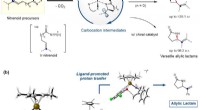 Ny katalytisk tilgang til adgang til nøglemellemkarbokation98%). (b) Beregningsmodellering til at bevise mellemvirkningen af carbocation og for at forstå det selektivitetsbestemmende trin. Kredit:IBS Den menneskelige civilisation i det 21. århundrede er
Ny katalytisk tilgang til adgang til nøglemellemkarbokation98%). (b) Beregningsmodellering til at bevise mellemvirkningen af carbocation og for at forstå det selektivitetsbestemmende trin. Kredit:IBS Den menneskelige civilisation i det 21. århundrede er -
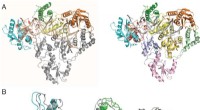 Forskning afslører strukturen af human endogen revers transkriptaseOversigt over HERV-K RT struktur. (A ) HERV-K RT med molA-underdomænerne farvet efter konvention og molB-underenheden farvet i gråt (Venstre ). Til højre , molA og molB er farvet af underdomæne. MolA:
Forskning afslører strukturen af human endogen revers transkriptaseOversigt over HERV-K RT struktur. (A ) HERV-K RT med molA-underdomænerne farvet efter konvention og molB-underenheden farvet i gråt (Venstre ). Til højre , molA og molB er farvet af underdomæne. MolA: -
 Forskere skaber brintbrændstof fra havvandEn prototype -enhed brugte solenergi til at skabe brintbrændstof fra havvand. Kredit:H. Dai, Yun Kuang, Michael Kenney Stanford -forskere har udtænkt en måde at generere brintbrændstof ved hjælp a
Forskere skaber brintbrændstof fra havvandEn prototype -enhed brugte solenergi til at skabe brintbrændstof fra havvand. Kredit:H. Dai, Yun Kuang, Michael Kenney Stanford -forskere har udtænkt en måde at generere brintbrændstof ved hjælp a -
 Meget stabil vandelektrolysekatalysator til produktion af brint og oxygenSkematisk diagram over foreslåede gebyroverførselsprocesser mellem MoSe 2 og LSC. Kredit:UNIST En nylig undersøgelse, tilknyttet UNIST har præsenteret ædle katalysatorer til vandelektrolyse, i s
Meget stabil vandelektrolysekatalysator til produktion af brint og oxygenSkematisk diagram over foreslåede gebyroverførselsprocesser mellem MoSe 2 og LSC. Kredit:UNIST En nylig undersøgelse, tilknyttet UNIST har præsenteret ædle katalysatorer til vandelektrolyse, i s
- Hvor meget regn falder der i den tætte jungle hvert år?
- Hvad er funktionen af en prokatyotisk celle?
- Kan månen ses hvor som helst når som helst?
- Ny forskning forklarer, hvordan HIV undgår at blive ZAPped
- Hvad er voldelige eksplosioner fra solflekker, hvor gas og enorme mængder energi sprang ud i rummet…
- Producerer solen energi i Photosphere Core eller Corona?


