Hvorfor er det 2 atomer af fluor har de samme egenskaber, men forskellige masser?
Her er hvorfor:
* isotoper: Fluor har kun en naturligt forekommende isotop, hvilket betyder, at alle fluoratomer har det samme antal protoner (9) og elektroner (9). De kan dog have forskellige antal neutroner.
* Massenummer: Massenummeret er det samlede antal protoner og neutroner i en atoms kerne. Mens alle fluoratomer har 9 protoner, har nogle 10 neutroner (fremstiller deres masse nummer 19), og nogle har 9 neutroner (hvilket gør deres masse nummer 18). Disse kaldes isotoper af fluor:fluor-19 og fluor-18.
* Masseforskelle: Fluor-19 er den mest almindelige og stabile isotop, der udgør næsten 100% af naturligt forekommende fluor. Fluor-18 er meget sjældnere og er radioaktiv. Dette betyder, at det over tid nedbrydes til andre elementer og frigiver energi.
Derfor kan to atomer af fluor have forskellige masser på grund af tilstedeværelsen af forskellige antal neutroner (isotoper). Denne forskel i masse kan også føre til små variationer i nogle fysiske egenskaber, såsom deres reaktivitet og hvordan de interagerer med andre elementer. De vil dog stadig dele de samme kemiske egenskaber, fordi de har det samme antal protoner og elektroner.
 Varme artikler
Varme artikler
-
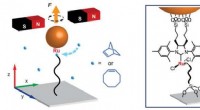 Nærbillede af voksende polymerkæde viser hoppetrinSkematisk af magnetisk pincet måling af en voksende polymer bundet mellem et dækglas og en magnetisk partikel. Monomerer (blå kugler) er inkorporeret af den Ru-baserede katalysator. (Til højre) Forbin
Nærbillede af voksende polymerkæde viser hoppetrinSkematisk af magnetisk pincet måling af en voksende polymer bundet mellem et dækglas og en magnetisk partikel. Monomerer (blå kugler) er inkorporeret af den Ru-baserede katalysator. (Til højre) Forbin -
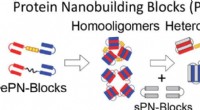 Forskere udvikler proteiner, der samler sig til supramolekylære komplekserDesignet af nye proteiner, der selv samles til supramolekylære komplekser, er vigtig for udviklingen inden for nanobioteknologi og syntetisk biologi. Kredit:© 2018, American Chemical Society Et sa
Forskere udvikler proteiner, der samler sig til supramolekylære komplekserDesignet af nye proteiner, der selv samles til supramolekylære komplekser, er vigtig for udviklingen inden for nanobioteknologi og syntetisk biologi. Kredit:© 2018, American Chemical Society Et sa -
 Rekonstitueret silke kan være flere gange stærkere end den naturlige fiber og fremstillet i forske…Et fotografi viser regenererede spiralformede silkefibre farvet af Rhodamine farvestoffer, under UV-lys. Kredit:Massachusetts Institute of Technology Når det kommer til at lave den komplekse bland
Rekonstitueret silke kan være flere gange stærkere end den naturlige fiber og fremstillet i forske…Et fotografi viser regenererede spiralformede silkefibre farvet af Rhodamine farvestoffer, under UV-lys. Kredit:Massachusetts Institute of Technology Når det kommer til at lave den komplekse bland -
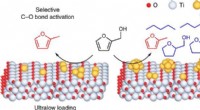 Opgradering af biomasse med selektive overflademodificerede katalysatorerForskere læste enkelte atomer af platin (gul) oven på titania, en forbindelse, der indeholder titanium (grå) og oxygen (rød). Denne katalysator bryder selektivt en binding mellem et kulstof og oxygen
Opgradering af biomasse med selektive overflademodificerede katalysatorerForskere læste enkelte atomer af platin (gul) oven på titania, en forbindelse, der indeholder titanium (grå) og oxygen (rød). Denne katalysator bryder selektivt en binding mellem et kulstof og oxygen
- Hvordan klimaforskere optrævler mysterierne i det sydlige Ocean
- Hvad er en pludselig stigning i kromosfærersolens lysstyrke?
- Formlen for jernoxidatype af rust er 2FE03. Hvor mange atomer i et molekyle A.1 B.2?
- Storme forårsagede massivt tab af havis i Antarktis i 2016
- Giver en Equinox overalt på jorden på samme tid?
- Hvad er forskellen mellem endelig matematik og forudregning?


