Når zinkstangen dyppes i sulfat Sol, vil koncentrationen af opløsning efter tiden være?
reaktionen:
Zink (Zn) er mere reaktiv end mange metaller, inklusive metallet, der danner den positive ion i en sulfatopløsning (som kunne være kobber, jern osv.). Når zink dyppes i en sulfatopløsning, gennemgår den en forskydningsreaktion .
Zink reagerer med sulfationerne i opløsningen, forskyder metalionen fra opløsningen og danner zinksulfat. Dette er repræsenteret af følgende generelle reaktion:
Zn (S) + M 2 + (aq) + så 4 2- (aq) → Zn 2+ (aq) + så 4 2- (aq) + m (s)
Koncentrationsændringer:
* Fald i metalionkoncentration: Metalionerne, der oprindeligt var til stede i opløsningen (m 2+ ) erstattes af zinkioner (Zn 2+ ). Derfor vil koncentrationen af metalionen falde.
* Forøgelse i zinkionkoncentration: Når zink reagerer, danner det zinkioner (Zn 2+ ), hvilket øger koncentrationen af zinkioner i opløsningen.
* sulfationkoncentration forbliver relativt konstant: Sulfationerne (så 4 2- ) forbruges ikke i reaktionen; De skifter simpelthen partnere fra den originale metalion til zinkionen.
samlet effekt:
Koncentrationen af sulfatopløsningen ændres over tid. Specifikt:
* Koncentrationen af den originale metalion vil mindske .
* Koncentrationen af zinkioner vil øge .
* Koncentrationen af sulfationer forbliver relativt konstant .
Faktorer, der påvirker hastigheden:
* metalens natur: Zinkens reaktivitet sammenlignet med den originale metalion vil bestemme reaktionshastigheden. Mere reaktiv zink vil føre til en hurtigere reaktion.
* Koncentration af opløsningen: En højere koncentration af den originale metalion vil oprindeligt føre til en hurtigere reaktionshastighed.
* Temperatur: Højere temperaturer øger generelt reaktionshastigheden.
Vigtig note: Hvis sulfatopløsningen er meget koncentreret, kan du se dannelsen af zinksulfatudfældning, hvilket ville fjerne zinkioner fra opløsningen og påvirke de samlede koncentrationsændringer.
 Varme artikler
Varme artikler
-
 Elektrisk ledende maling og andre polymerlegeringer fremstilles nu letForskere fra University of Tsukuba og samarbejdspartnere fremstillede polyanilin i en lang række billige opløsningsmidler. Denne udvikling vil lette avancerede anvendelser inden for printkort og andre
Elektrisk ledende maling og andre polymerlegeringer fremstilles nu letForskere fra University of Tsukuba og samarbejdspartnere fremstillede polyanilin i en lang række billige opløsningsmidler. Denne udvikling vil lette avancerede anvendelser inden for printkort og andre -
 Superfleksible elektroluminescerende enheder udvikletUdvikling af superfleksible elektroluminescerende enheder. Kredit:Pusan National University Fremtiden vil blive farvet af bøj-at-vilje lyskilder. En succesfuld forskningsundersøgelse udført af e
Superfleksible elektroluminescerende enheder udvikletUdvikling af superfleksible elektroluminescerende enheder. Kredit:Pusan National University Fremtiden vil blive farvet af bøj-at-vilje lyskilder. En succesfuld forskningsundersøgelse udført af e -
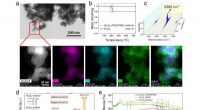 Direkte oxidativ overførselsproces bidrager til vandrensningProduktanalyser af modelreaktionssystemet (Co3 O4 /PMS/PhOH). et STEM, HAADF og EDS elementær kortlægningsbilleder af Co3 O4 efter reaktionen. b TGA-kurver for den uberørte og reagerede Co3 O4 i lufte
Direkte oxidativ overførselsproces bidrager til vandrensningProduktanalyser af modelreaktionssystemet (Co3 O4 /PMS/PhOH). et STEM, HAADF og EDS elementær kortlægningsbilleder af Co3 O4 efter reaktionen. b TGA-kurver for den uberørte og reagerede Co3 O4 i lufte -
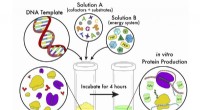 Forenklet metode gør cellefri proteinsyntese mere fleksibel og tilgængeligEn tegneserie af cellefri proteinsyntese, en bioteknologi, der udnytter cellens genetiske kode i et reagensglas. Skematikken repræsenterer en forenklet tilgang, der gør det muligt for forskere at udfø
Forenklet metode gør cellefri proteinsyntese mere fleksibel og tilgængeligEn tegneserie af cellefri proteinsyntese, en bioteknologi, der udnytter cellens genetiske kode i et reagensglas. Skematikken repræsenterer en forenklet tilgang, der gør det muligt for forskere at udfø
- Nyt navn til Facebook? Kritikere græder røg og spejler
- Er månen eller solen lysere?
- Højhastigheds FM-AFM og simulering afslører atomistiske opløsningsprocesser af calcit i vand
- Er din sandwich dårlig for miljøet?
- Regelmæssige arrays af siliciumnanopartikler nøglen til at forbedre lysemissioner i nanofotoniske …
- Fysikere sænker tærsklen for at detektere ekstremt svage magnetiske signaler


