Hvordan er de ædle gasser forskellige fra andre familier på periodisk bord?
1. Fuld valence shell:
- ædle gasser har en fuld ydre skal af elektroner, hvilket gør dem usædvanligt stabile og ureaktive. Denne fulde shell -konfiguration er nøglen til deres inerte natur.
2. Mangel på farve og lugt:
- De fleste ædle gasser er farveløse og lugtløse under standardforhold. Dette skyldes deres inerte natur, da de ikke let danner bindinger og deltager i kemiske reaktioner.
3. Monoatomisk eksistens:
- Der findes ædle gasser som enkeltatomer (monatomiske) snarere end at danne molekyler. Dette er en direkte konsekvens af deres stabile elektronkonfiguration, som forhindrer dem i at dele elektroner til at danne bindinger.
4. Lav kogepunkter:
- På grund af deres svage interatomiske kræfter har ædle gasser meget lave kogepunkter. Helium har for eksempel det laveste kogepunkt for alle elementer.
5. Fundet i spormængder i atmosfæren:
- ædle gasser findes i meget små mængder i atmosfæren. Deres inerte natur forhindrer dem i at reagere med andre elementer og danne forbindelser, hvilket bidrager til deres lave atmosfæriske overflod.
6. Begrænset kemisk reaktivitet:
- Selvom det engang blev betragtet som helt ureaktive, har nogle ædelgasser vist sig at danne forbindelser under specifikke forhold, især med stærkt elektronegative elementer som fluor. Deres samlede reaktivitet forbliver imidlertid ekstremt begrænset sammenlignet med andre elementgrupper.
7. Ansøgninger:
- På trods af deres begrænsede reaktivitet har ædle gasser adskillige anvendelser inden for forskellige områder:
- helium: Brugt i balloner, kryogenik og MR -maskiner.
- neon: Brugt i neonskilte og lasere.
- argon: Brugt i svejsning, lyspærer og som en inert atmosfære til kemiske processer.
- krypton: Brugt i lasere og belysning med høj intensitet.
- xenon: Brugt i flashlamper, lasere og som bedøvelsesmiddel.
Sammenfattende er de ædle gasser unikke på grund af deres fulde valensskal, hvilket resulterer i deres inerte natur, mangel på farve og lugt, monoatomisk eksistens, lave kogepunkter, begrænset kemisk reaktivitet og forskellige anvendelser.
 Varme artikler
Varme artikler
-
 Fjernstyret lægemiddeltilførsel implantatstørrelse af druer kan hjælpe med at håndtere kronisk …Fjernstyret, implanterbart nanokanal lægemiddelleveringssystem (nDS) skabt af nanomedicin-forskere ved Houston Methodist Research Institute. Kredit:Houston Methodist Mennesker med kroniske sygdomm
Fjernstyret lægemiddeltilførsel implantatstørrelse af druer kan hjælpe med at håndtere kronisk …Fjernstyret, implanterbart nanokanal lægemiddelleveringssystem (nDS) skabt af nanomedicin-forskere ved Houston Methodist Research Institute. Kredit:Houston Methodist Mennesker med kroniske sygdomm -
 Sporing af proteinpatruljereEn nanoprobe udviklet af biofysikere ved NC State kunne give forskere mulighed for at spore bevægelserne af forskellige proteiner langs DNA - uden ulemperne ved de nuværende metoder. Et væld af prote
Sporing af proteinpatruljereEn nanoprobe udviklet af biofysikere ved NC State kunne give forskere mulighed for at spore bevægelserne af forskellige proteiner langs DNA - uden ulemperne ved de nuværende metoder. Et væld af prote -
 Tekstilsensorplaster lavet med ledende garn kunne registrere trykpunkter for amputeredeForsker fandt ud af, at en tekstilsensor kan detektere trykpunkter på soklen på en protese. Kredit:North Carolina State University En blød, fleksibelt sensorsystem skabt med elektrisk ledende garn
Tekstilsensorplaster lavet med ledende garn kunne registrere trykpunkter for amputeredeForsker fandt ud af, at en tekstilsensor kan detektere trykpunkter på soklen på en protese. Kredit:North Carolina State University En blød, fleksibelt sensorsystem skabt med elektrisk ledende garn -
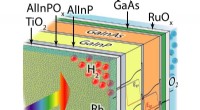 Ny verdensrekord for direkte solvandsspaltningseffektivitetDet gennemsigtige anti-korrosionslag indeholder Rhodium nanopartikler som katalysator. Kredit:ACS Energy Letters. Brint vil spille en central rolle som lagringsmedium i bæredygtige energisystemer.
Ny verdensrekord for direkte solvandsspaltningseffektivitetDet gennemsigtige anti-korrosionslag indeholder Rhodium nanopartikler som katalysator. Kredit:ACS Energy Letters. Brint vil spille en central rolle som lagringsmedium i bæredygtige energisystemer.
- Ny nanoenhed bygger elektricitet af små stykker
- Robust ny proces danner 3D-former fra flade ark af grafen
- Hvorfor 9 til 5 ikke er det eneste skift, der kan fungere for travle familier
- Hvad er de 2 dage af året, hvor hverken halvkuglen vippes mod sol?
- For at mindske CO2-udledningen, se til lokal transport og boliger
- At undskylde over for kunderne efter produktfejl kan tilskynde til genkøb, afværge retssager


