Hvad er de fire mekanismer, der får underlag til overgangstilstand?
1. Nærhed og orientering: Enzymer samler reaktanter i den korrekte orientering for at lette reaktionen. Dette reducerer systemets entropi, hvilket gør reaktionen mere gunstig.
2. Stamme eller forvrængning: Enzymer kan binde underlag på en måde, der forvrænger deres form, hvilket gør dem mere reaktive. Dette opnås ofte ved bindingssubstrater i en konformation tæt på overgangstilstanden.
3. Elektrostatiske interaktioner: Enzymer kan bruge ladede aminosyrer eller kofaktorer til at stabilisere overgangstilstanden og sænke dens energi. Dette er især vigtigt for reaktioner, der involverer ladede mellemprodukter.
4. Syre-base-katalyse: Enzymer kan bruge aminosyrerester til at donere eller acceptere protoner, hvilket letter dannelsen af overgangstilstanden. Dette er afgørende for reaktioner, der involverer protonoverførsel.
Andre vigtige mekanismer:
* metalionkatalyse: Nogle enzymer bruger metalioner til at stabilisere ladede mellemprodukter eller for at lette redoxreaktioner.
* kovalent katalyse: Enzymer kan danne midlertidige kovalente bindinger med underlag for at ændre deres reaktivitet.
Det er vigtigt at huske, at disse mekanismer ofte fungerer sammen i et komplekst samspil for at opnå den ønskede katalytiske effekt. Den specifikke mekanisme afhænger af det individuelle enzym og reaktion, der katalyseres.
 Varme artikler
Varme artikler
-
 Nye proteinstrukturer for at hjælpe rationelt lægemiddeldesignKunstnerisk gengivelse af et proteinkinase C C1-domæne (kobber), dets ligand diacylglycerol (blå) og detergent (cyan). Kredit:Sachin Katti. Som et stort fremskridt for rationelt lægemiddeldesign ha
Nye proteinstrukturer for at hjælpe rationelt lægemiddeldesignKunstnerisk gengivelse af et proteinkinase C C1-domæne (kobber), dets ligand diacylglycerol (blå) og detergent (cyan). Kredit:Sachin Katti. Som et stort fremskridt for rationelt lægemiddeldesign ha -
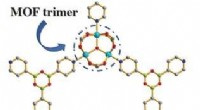 Meget resorptive metal-organiske rammerKredit:Angewandte Chemie International Edition Gasser og forurenende stoffer kan filtreres fra luft og væsker ved hjælp af porøse, krystallinske materialer, såsom metal-organiske rammer (MOFer). F
Meget resorptive metal-organiske rammerKredit:Angewandte Chemie International Edition Gasser og forurenende stoffer kan filtreres fra luft og væsker ved hjælp af porøse, krystallinske materialer, såsom metal-organiske rammer (MOFer). F -
 Forskere skaber tilpassede, stoflignende strømkilde til bærbar elektronikSuperkondensatoren fungerer godt, selv når den er strakt. Kredit:NTU Singapore Forskere ved Nanyang Technological University, Singapore, har skabt en tilpasselig, stoflignende strømkilde, der kan
Forskere skaber tilpassede, stoflignende strømkilde til bærbar elektronikSuperkondensatoren fungerer godt, selv når den er strakt. Kredit:NTU Singapore Forskere ved Nanyang Technological University, Singapore, har skabt en tilpasselig, stoflignende strømkilde, der kan -
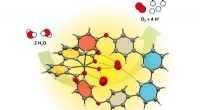 Kunstigt enzym opdeler vand mere effektivtEnzymlignende vandfororganisering foran en Ruthenium-vandoxidationskatalysator. Kredit:Würthner-gruppen / Würzburg Universitet Menneskeheden står over for en central udfordring:Den skal klare overg
Kunstigt enzym opdeler vand mere effektivtEnzymlignende vandfororganisering foran en Ruthenium-vandoxidationskatalysator. Kredit:Würthner-gruppen / Würzburg Universitet Menneskeheden står over for en central udfordring:Den skal klare overg


