Hvordan identificerer du, om et stof er metal matalloid eller ikke metal?
1. Metaller
* Fysiske egenskaber:
* skinnende: De fleste metaller har en skinnende, reflekterende overflade.
* formbar: De kan hamres i tynde lagner.
* duktil: De kan trækkes ind i ledninger.
* Gode ledere: De udfører varme og elektricitet godt.
* fast ved stuetemperatur: (Bortset fra kviksølv, der er flydende)
* Høj densitet: Metaller er generelt tæt.
* Kemiske egenskaber:
* formkationer: De har en tendens til at miste elektroner og danne positivt ladede ioner (kationer).
* reaktiv: Nogle metaller er meget reaktive (som natrium og kalium), mens andre er mindre reaktive (som guld og platin).
2. Ikke -metaller
* Fysiske egenskaber:
* kedelig: Ikke -metaller mangler et skinnende udseende.
* sprød: De har en tendens til at bryde let.
* Dårlige ledere: De er dårlige ledere af varme og elektricitet (undtagen kulstof i form af grafit).
* Gasser ved stuetemperatur: Mange ikke -metaller er gasser ved stuetemperatur (ilt, nitrogen, klor).
* lav densitet: Ikke -metaller er generelt mindre tætte end metaller.
* Kemiske egenskaber:
* Form anioner: De har en tendens til at vinde elektroner og danne negativt ladede ioner (anioner).
* Varieret reaktivitet: Ikke -metaller udviser en lang række reaktivitet.
3. Metalloider (semimetaler)
* egenskaber: Metalloider har egenskaber, der falder et sted mellem metaller og ikke -metaller.
* halvledere: De udfører elektricitet bedre end ikke -metaller, men ikke så godt som metaller. Deres ledningsevne kan kontrolleres, hvilket gør dem værdifulde inden for elektronik.
* sprød: Metalloider er generelt sprøde.
* skinnende eller kedeligt: Deres udseende kan variere.
* fast ved stuetemperatur: Metalloider er faste ved stuetemperatur.
Eksempler:
* Metaller: Jern (Fe), kobber (Cu), guld (AU), aluminium (AL), sølv (AG)
* ikke -metaller: Oxygen (O), nitrogen (N), klor (CL), svovl (er), fosfor (P), brom (BR)
* Metalloider: Silicon (SI), Germanium (GE), Arsenic (AS), Antimon (SB), Tellurium (TE)
Nøglepunkt: Selvom disse egenskaber er nyttige til at identificere metaller, ikke -metaller og metalloider, er der undtagelser fra enhver regel. Se altid en periodisk tabel for bekræftelse.
 Varme artikler
Varme artikler
-
 Bekæmper evigt kemikalier med mikroberKredit:Pixabay/CC0 Public Domain Per- og polyfluoroalkylstoffer (PFAS) er nogle af de mest persistente miljøforurenende stoffer, tjene dem monikeren evigt kemikalier. Stigende bekymring for de neg
Bekæmper evigt kemikalier med mikroberKredit:Pixabay/CC0 Public Domain Per- og polyfluoroalkylstoffer (PFAS) er nogle af de mest persistente miljøforurenende stoffer, tjene dem monikeren evigt kemikalier. Stigende bekymring for de neg -
 Et nyt materiale til fremtidens batteriUCLouvains forskere opdagede et nyt højtydende og sikkert batterimateriale (LTPS), der kan fremskynde opladning og afladning til et niveau, der aldrig er observeret hidtil. Kredit:University of Louvai
Et nyt materiale til fremtidens batteriUCLouvains forskere opdagede et nyt højtydende og sikkert batterimateriale (LTPS), der kan fremskynde opladning og afladning til et niveau, der aldrig er observeret hidtil. Kredit:University of Louvai -
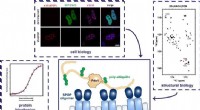 Hvordan ved et reguleringsprotein, hvor det skal bindes for at modulere insulinproduktionen?Penn State -forskere brugte en række forskellige teknikker vedrørende cellebiologi, strukturel biologi, og proteinbiofysik for at bestemme, hvordan proteinerne SPOP og Pdx1 fungerer sammen for at sikr
Hvordan ved et reguleringsprotein, hvor det skal bindes for at modulere insulinproduktionen?Penn State -forskere brugte en række forskellige teknikker vedrørende cellebiologi, strukturel biologi, og proteinbiofysik for at bestemme, hvordan proteinerne SPOP og Pdx1 fungerer sammen for at sikr -
 Undersøgelse opdager nyt leveringssystem, der kan hjælpe med at forhindre bakterielle infektionerKredit:CC0 Public Domain I en nylig undersøgelse i Journal of The American Chemical Society , Professor Tewodros Asefa og lektor Jeffrey Boyd syntetiserede nanostrukturerede silicapartikler, ans
Undersøgelse opdager nyt leveringssystem, der kan hjælpe med at forhindre bakterielle infektionerKredit:CC0 Public Domain I en nylig undersøgelse i Journal of The American Chemical Society , Professor Tewodros Asefa og lektor Jeffrey Boyd syntetiserede nanostrukturerede silicapartikler, ans
- Hvorfor er solen lysere end alle andre stjerner?
- Hjerne-inspireret AI inspirerer til indsigt om hjernen (og omvendt)
- En klæbrig situation i udvikling
- Hvilket væv sender beskeder fra hjerne til krop?
- Hvordan påvirker videnskab din daglige liv?
- En nøglebrik til at forstå, hvordan kvantetyngdekraften påvirker lavenergifysik


