Hvorfor benzin er brandfarlig og vand ikke, selvom begge er væsker?
benzin (benzin):
* sammensætning: Benzin er en kompleks blanding af kulbrinter, primært alkaner med forskellige kulstofkædelængder.
* molekylær struktur: Kulbrinter har en høj andel af carbon- og brintatomer, der danner stærke bindinger. Disse bindinger brydes let af varme, frigiver energi og danner stærkt reaktive molekyler.
* Flammbarhed: Tilstedeværelsen af mange kulstof-hydrogenbindinger gør benzin let brændbar. Varmen fra en gnist eller en flamme giver energien til at bryde disse bindinger, hvor en kædereaktion indledes, der frigiver mere varme og hurtigt spreder ild.
Vand:
* sammensætning: Vand er et simpelt molekyle sammensat af to hydrogenatomer og et iltatom (H2O).
* molekylær struktur: Oxygenatomet danner stærke polære kovalente bindinger med brintatomerne. Denne polære struktur resulterer i hydrogenbinding, hvilket gør vand til et meget stabilt molekyle.
* Ikke-lammbarhed: Vand er ikke brandfarligt, fordi de stærke bindinger mellem brint- og iltatomer kræver en betydelig mængde energi at bryde. Denne energi er ikke let tilgængelig fra en simpel gnist eller flamme. Derudover er vandmolekyler meget resistente over for oxidation (brændende) og hæmmer aktivt forbrændingsprocessen.
Nøgleforskel: Den vigtigste forskel ligger i kemisk bindingsstyrke og molekylstruktur . Benzin, med sin overflod af svagere kulstof-hydrogenbindinger, frigiver let energi og danner reaktive molekyler, når de udsættes for varme, hvilket gør det brandfarligt. Vand med sine stærke polære bindinger og stabile struktur kræver meget mere energi til at bryde sammen og er ikke let brændbar.
Kortfattet: Benzinens kemiske sammensætning og molekylære struktur gør det meget brandfarligt, mens Water's unikke struktur og stærke bindinger gør det ikke-brandfarligt.
Sidste artikelHvilken type molekyler polær eller ikke opløses i vand?
Næste artikelPrincipmolekyle, der udfører instruktionerne kodet i DNA?
 Varme artikler
Varme artikler
-
 Fiskeaffald som råmateriale til industrivarerForskere Revilija Mozuraityte og Rasa Slizyte i SINTEF-laboratoriet, hvor de analyserer olier, gelatine, og smagsneutrale proteiner afledt af de resterende råvarer efter laksefiletering. Kredit:Håvard
Fiskeaffald som råmateriale til industrivarerForskere Revilija Mozuraityte og Rasa Slizyte i SINTEF-laboratoriet, hvor de analyserer olier, gelatine, og smagsneutrale proteiner afledt af de resterende råvarer efter laksefiletering. Kredit:Håvard -
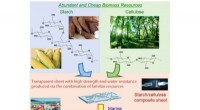 Forskere skaber vandnedbrydelig plast, der kombinerer stivelse og celluloseFig. 1. Marine bionedbrydeligt plastpræparat fra stivelse og cellulose. Kredit:Osaka University Hovedårsagen til akkumulering af havaffald er dumpning af plastikaffald i havene, da det meste plast
Forskere skaber vandnedbrydelig plast, der kombinerer stivelse og celluloseFig. 1. Marine bionedbrydeligt plastpræparat fra stivelse og cellulose. Kredit:Osaka University Hovedårsagen til akkumulering af havaffald er dumpning af plastikaffald i havene, da det meste plast -
 Forskere afslører mysteriet om, hvordan stråling svækker metal, ét atom ad gangenDet analyserede GB og dets omgivende miljø. (A) Automatiseret krystalorienteringskortlægning, der viser kornorienteringerne i nærheden af grænsefladen af interesse. Grænsen af interesse adskille
Forskere afslører mysteriet om, hvordan stråling svækker metal, ét atom ad gangenDet analyserede GB og dets omgivende miljø. (A) Automatiseret krystalorienteringskortlægning, der viser kornorienteringerne i nærheden af grænsefladen af interesse. Grænsen af interesse adskille -
 Sådan får du salt ud af vandet:Få det til at skubbe ud af sig selvDa forskerne begyndte at studere den måde, salte krystalliserer på visse overflader, de fandt ud af, at processen gentagne gange producerede forudsigelige flerbenede former. Forskerne kaldte dem kolle
Sådan får du salt ud af vandet:Få det til at skubbe ud af sig selvDa forskerne begyndte at studere den måde, salte krystalliserer på visse overflader, de fandt ud af, at processen gentagne gange producerede forudsigelige flerbenede former. Forskerne kaldte dem kolle
- Hvad bruger Neil DeGrasse Tyson som en metafor for, hvordan vi fødes i universets universets?
- Sådan designer du et sejl, der ikke river eller smelter på en interstellar rejse
- Hvad er de to vigtigste kategorier af tektoniske processer, der former overfladen?
- Hvad gør en patentagent?
- Fish and chips på Mars:Forskning viser, hvordan kolonister kunne producere deres egen mad
- Hvilke områder har svage vinde?


