Hvilken type molekyler polær eller ikke opløses i vand?
Forklaring:
Vand er et polært molekyle, hvilket betyder, at det har en positiv og negativ ende på grund af den ujævne deling af elektroner mellem ilt- og brintatomer. Denne polaritet tillader vandmolekyler at danne hydrogenbindinger med andre polære molekyler.
polære molekyler:
* Har en ujævn fordeling af elektroner, der skaber delvis positive og negative afgifter.
* Kan danne hydrogenbindinger med vandmolekyler.
* Er opløselige i vand.
Eksempler på polære molekyler:
* Sukker (f.eks. Glukose)
* Alkoholer (f.eks. Ethanol)
* Syrer (f.eks. Haltsyre)
* Salte (f.eks. Natriumchlorid)
ikke -polære molekyler:
* Har en jævn fordeling af elektroner uden nogen væsentlige afgifter.
* Kan ikke danne hydrogenbindinger med vandmolekyler.
* Er uopløselige i vand.
Eksempler på ikke -polære molekyler:
* Olier (f.eks. Vegetabilsk olie)
* Fedtstoffer (f.eks. Smør)
* Gasser (f.eks. Nitrogen, ilt)
* Kulbrinter (f.eks. Metan)
"Like opløser som" princip:
Polære molekyler opløses i polære opløsningsmidler (som vand), mens ikke -polære molekyler opløses i ikke -polære opløsningsmidler. Dette princip er baseret på det faktum, at lignende intermolekylære kræfter findes mellem opløsningsmiddel- og opløsningsmiddelmolekyler.
 Varme artikler
Varme artikler
-
 Kemikere opdager hurtigere virkende former for insekticid imidaclopridNYU-kemikere udviklede nye krystalformer af imidacloprid - et af verdens mest udbredte insekticider - i et forsøg på at reducere dets miljøpåvirkning kraftigt. Kredit:Xiaolong Zhu Forskere har udv
Kemikere opdager hurtigere virkende former for insekticid imidaclopridNYU-kemikere udviklede nye krystalformer af imidacloprid - et af verdens mest udbredte insekticider - i et forsøg på at reducere dets miljøpåvirkning kraftigt. Kredit:Xiaolong Zhu Forskere har udv -
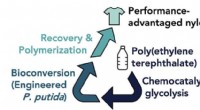 Forskere konstruerer mikroorganismer til at tackle PET-plastikforureningNREL- og ORNL-forskere har udviklet en metode til at opgradere PET til præstationsfordelagtig nylon, en forløber for andre værdifulde produkter såsom vandtæt tøj, stiftfri belægning af køkkengrej, og
Forskere konstruerer mikroorganismer til at tackle PET-plastikforureningNREL- og ORNL-forskere har udviklet en metode til at opgradere PET til præstationsfordelagtig nylon, en forløber for andre værdifulde produkter såsom vandtæt tøj, stiftfri belægning af køkkengrej, og -
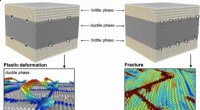 Foreslået ingeniørmetode kunne bidrage til at gøre bygninger og broer sikrereGrænseflade-dislokationskontrolleret deformation og fraktur i nanolagskompositter. Afstanden mellem grænsefladeforskydninger, som optager misfit-belastning mellem ferrit- og cementitfasen, bestemmer f
Foreslået ingeniørmetode kunne bidrage til at gøre bygninger og broer sikrereGrænseflade-dislokationskontrolleret deformation og fraktur i nanolagskompositter. Afstanden mellem grænsefladeforskydninger, som optager misfit-belastning mellem ferrit- og cementitfasen, bestemmer f -
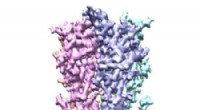 Serotoninreceptorstruktur i fuld længde set for første gangKredit:Case Western Reserve University Et team af forskere fra Case Western Reserve University School of Medicine har brugt nobelprisvindende mikroskopteknologi til at se fuldlængde serotoninrecep
Serotoninreceptorstruktur i fuld længde set for første gangKredit:Case Western Reserve University Et team af forskere fra Case Western Reserve University School of Medicine har brugt nobelprisvindende mikroskopteknologi til at se fuldlængde serotoninrecep
- Hver dag modtager Jorden 10000 gange den samlede energi, der bruges af alle mennesker. Kilden til de…
- Hvor er der en vulkan i Wisconsin?
- Hvor sikker er GSM -mobiltelefonnetværket?
- Hvor mange planter arter findes på Jorden?
- Ikke alt kød er skabt ens:Hvordan kostændringer kan opretholde verdens fødevareproduktion
- Er ligestilling på arbejdspladsen økonomiens skjulte motor?


