Serotoninreceptorstruktur i fuld længde set for første gang
Kredit:Case Western Reserve University
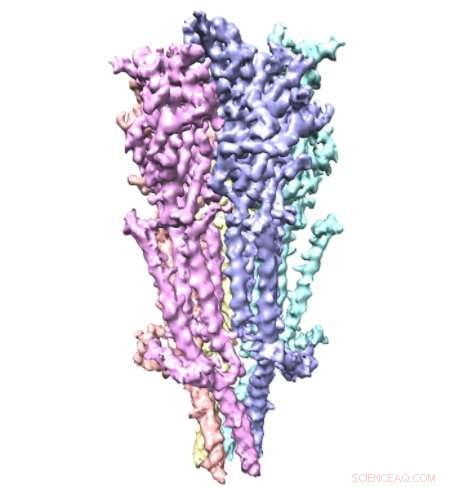
Et team af forskere fra Case Western Reserve University School of Medicine har brugt nobelprisvindende mikroskopteknologi til at se fuldlængde serotoninreceptorer for første gang. De små proteiner - cirka en milliardtedel meter lange - er almindelige lægemiddelmål, trods begrænset tilgængelig information om deres struktur. Nu, nye billeder offentliggjort i Naturkommunikation give øjebliksbilleder af receptorerne, herunder detaljer om molekylære bindingssteder, der kunne føre til mere præcist lægemiddeldesign.
Serotoninreceptorer sidder i cellemembraner i hele kroppen, inklusive hjernen, mave, og nerver. De er meget dynamiske med mange bevægelige dele, gør dem svære at fange. Forskere bryder almindeligvis receptoren i stykker for at studere den. Men ved at studere fuldlængde serotoninreceptorer, forskere i den nye undersøgelse viste, hvordan dens forskellige dele interagerer. Forskerne beskriver "en finjusteret orkestrering af tre domænebevægelser", der gør det muligt for receptorerne elegant at kontrollere passager på tværs af cellemembraner.
Undersøgelsen afslører, hvordan serotoninreceptorer virker, siger undersøgelsens første forfatter Sandip Basak, PhD, postdoc i afdelingen for fysiologi og biofysik ved Case Western Reserve University School of Medicine. "Serotoninreceptoren fungerer som en gateway, eller kanal, fra uden for cellen til inde, " siger han. "Når serotonin binder sig til receptoren, kanalen skifter konformation fra lukket til åben. Det forvandler sig til sidst til en "desensibiliseret" tilstand, hvor kanalen lukker, men serotonin forbliver vedhæftet. Dette forhindrer det i at blive reaktiveret." Forskellige konformationer hjælper serotoninreceptorer med at fungere som "gatekeepere" i cellemembraner.
Lægemidler, der binder sig til serotoninreceptorer og hæmmer dem - også kaldet Setrons - er almindeligt ordineret til at kontrollere opkastninger forbundet med kræftbehandlinger og gastrointestinale sygdomme. Men mange af disse stoffer kommer med alvorlige bivirkninger. "Mange mennesker, der tager disse stoffer, oplever ubehagelige symptomer. Disse bivirkninger har forhindret mere udbredt brug, " siger studieleder Sudha Chakrapani, PhD, lektor i fysiologi og biofysik ved Case Western Reserve University School of Medicine. Hun foreslår at designe lægemidler, der er rettet mod specifik konformation af serotoninreceptorer, kunne hjælpe.
"Succesfuldt design af sikrere behandlingsmidler er blevet langsommere, fordi der i øjeblikket er en begrænset forståelse af strukturen af selve serotoninreceptoren, og hvad sker der efter at serotonin binder sig, " siger Chakrapani. "Vores nye struktur af serotoninreceptoren i hviletilstand har potentialet til at tjene som en strukturel plan for at drive målrettet lægemiddeldesign og bedre terapeutiske strategier."
Den nyligt afslørede struktur sætter scenen for at bestemme strukturer af receptoren i de aktive og lægemiddelbundne former. Disse opdagelser er afgørende for at male et komplet billede af, hvordan receptoren virker. Forskere kunne anvende den samme teknologi, der blev brugt i den nye undersøgelse - kryo-elektronmikroskopi - for at afsløre yderligere serotoninreceptorkonformationer. Teknologien modtog en Nobelpris i 2017 og har allerede hjulpet forskere med at løse 3D-strukturer for proteiner, der er centrale for nyresten og andre lidelser. "Cryo-EM" gør det muligt for forskere at zoome ind og se proteinstrukturer i atomare detaljer. De højtydende mikroskoper tager øjebliksbilleder af proteiner i aktion, og kompiler dem til 3D strukturelle modeller.
Sidste artikelHvor gamle forbindelser kunne blive morgendagens livreddere
Næste artikelEn 3-D tilgang til at stoppe kræft i sine spor
 Varme artikler
Varme artikler
-
 Hvor meget vand er der behov for for at opløse salt?Ved stuetemperatur har du brug for mindst 100 gram vand for at opløse omkring 35 gram salt; hvis temperaturen ændrer sig, ændres imidlertid også den mængde salt, som vand kan opløses. Det punkt, hv
Hvor meget vand er der behov for for at opløse salt?Ved stuetemperatur har du brug for mindst 100 gram vand for at opløse omkring 35 gram salt; hvis temperaturen ændrer sig, ændres imidlertid også den mængde salt, som vand kan opløses. Det punkt, hv -
 Forskere rapporterer bio-inspirerede selektive antibiotikaSelektive antibiotika muliggør præcisionsindgreb i mikrobiomet (computergrafik). Kredit:Universitetet i Konstanz Da multiresistente bakterier bliver mere og mere en trussel, vi har mere end nogens
Forskere rapporterer bio-inspirerede selektive antibiotikaSelektive antibiotika muliggør præcisionsindgreb i mikrobiomet (computergrafik). Kredit:Universitetet i Konstanz Da multiresistente bakterier bliver mere og mere en trussel, vi har mere end nogens -
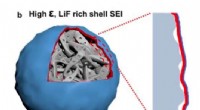 Et nyt elektrolytdesign, der kunne forbedre ydeevnen af Li-ion-batterierBillede, der viser en Si-partikel dækket af den LiF-rige SEI. Kredit:Chen et al. De fleste eksisterende lithium-ion-batterier (LIBer) integrerer grafitanoder, som har en kapacitet på cirka 350 mil
Et nyt elektrolytdesign, der kunne forbedre ydeevnen af Li-ion-batterierBillede, der viser en Si-partikel dækket af den LiF-rige SEI. Kredit:Chen et al. De fleste eksisterende lithium-ion-batterier (LIBer) integrerer grafitanoder, som har en kapacitet på cirka 350 mil -
 Materiale med højt brydningsindeks bevarer høj transmissivitet efter udglødning ved 850 grader CPh.D. studerende Takuya Yoshimoto holder en film af amorft tantal yttriumoxid. Kredit:Toyohashi University of Technology Toyohashi University of Technology-forskere i samarbejde med Massachusetts
Materiale med højt brydningsindeks bevarer høj transmissivitet efter udglødning ved 850 grader CPh.D. studerende Takuya Yoshimoto holder en film af amorft tantal yttriumoxid. Kredit:Toyohashi University of Technology Toyohashi University of Technology-forskere i samarbejde med Massachusetts
- Forskning afslører mere om TRAPPIST-1 planeter, og muligheden for liv
- Hvordan det ældste bevis på bevægelse kan ændre det, vi ved om livet på Jorden
- Solar orbiter klar til at forlade Europa
- Forbrugere villige til at betale mere for bæredygtigt brygget øl, undersøgelse finder
- Delhis fattige bærer hovedparten af dødbringende smog
- Lilla distrikter vælger de mest ekstreme lovgivere, driver polarisering


