En 3-D tilgang til at stoppe kræft i sine spor
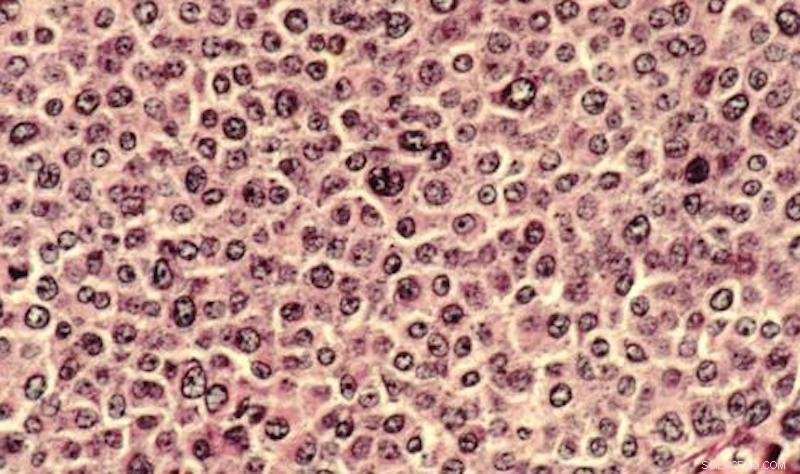
Kræftceller er traditionelt blevet undersøgt i petriskåle og på objektglas. Forskere har nu udviklet en 3D-model til at analysere kompleksiteten af kræftceller i et miljø, der i højere grad efterligner den menneskelige krop. Kredit:Dr. Cecil Fox, Offentligt domæne
Hver dag, omkring 100 milliarder nye celler skabes inde i menneskekroppen. Disse celler slutter sig til billioner af ældre celler for at danne de væv og organer, vi er afhængige af for at forblive i live. Nogle gange, når en celle oprettes, der sker en mutation i dets DNA, omdanne cellen til noget defekt og potentielt farligt for kroppens indre miljø. Som regel, en celle vil genkende sine egne defekter og hurtigt afslutte sig selv.
Men nogle gange, i stedet for at eliminere sig selv, den muterede celle replikerer, danner en tumor, der kan bryde fra hinanden, metastasere (dvs. migrere), og invadere andre dele af kroppen - ofte gennem blodbanen. Heldigvis, Carnegie Mellon Universitys professor i maskinteknik Philip LeDuc, i samarbejde med ph.d. studerende James Li Wan og Dr. Carola Neumann, en brystkræftforsker fra University of Pittsburgh, udviklet en patientorienteret model, videnskabsmænd kan bruge til bedre at forstå - og i sidste ende stoppe - kræftcellemigration.
Ifølge LeDuc, dette projekt startede på grund af den voksende interesse, forskere har vist i forholdet mellem fysisk videnskab og kræft. Da tumorer faktisk er fysisk masser, både biokemiske og fysiske midler kan påvirke kræftceller og tumorer. Efter at have overvejet sammenhængen mellem disse to emner, LeDuc, Neumann, og Wan vendte deres opmærksomhed mod metastase og cancercelleanalyse. Gennem deres samarbejde de var i stand til at udvikle en mere præcis og relevant måde at studere kræftceller på.
Selvom celleanalyse traditionelt foregår i en petriskål af plast, forskerholdet skabte en 3D-model, der mere præcist afspejler en organismes fysiologiske forhold. Med denne model, videnskabsmænd kan afdække og analysere kompleksiteten af kræftceller i et miljø, der i højere grad efterligner den menneskelige krop.
"Biologi er blevet undersøgt ved at sætte celler inde i petriskåle i årtier, " siger LeDuc. "Men spørgsmålet er, kan man lave systemer, der er mere fysiologisk relevante? Vi bruger mikrofluidisk og mikrofabrikationstilgange til at skabe tredimensionelle systemer, fordi celler findes i tredimensionelle væv - de ligger ikke naturligt i en 2D petriskål."
Typisk, mikrofluidiske systemer - systemer, der overfører væsker på mikroskopisk niveau - er lavet af plastik, men siden LeDuc, Neumann, og Wan søgte efter et mere fysiologisk relevant system, de skabte deres mikrofluidiske system ved hjælp af kollagen, det mest fremherskende protein i menneskekroppen.
"Som Phil sagde, Vi dyrker traditionelt celler i plastik og arbejder med dem i petriskåle, siger Neumann, en lektor i farmakologi og kemisk biologi ved University of Pittsburgh. "Men ingen steder i din krop har du plastik. At have et 3-D-system, der efterligner fysiologiske forhold, er en meget bedre måde at få hurtigere og mere relevante resultater på."
Hver mikrofluidisk enhed skabt af teamet indeholder to nøglekomponenter:et sæt parallelle kanaler, der efterligner traditionelle blodkar og en koncentration af kræftceller, der er indlejret i kollagenet.
Når først en enhed er konstrueret, kanalerne injiceres med et kemisk stimulans, der diffunderer ind i det omgivende kollagen. Når molekyler fra stimulanten bevæger sig længere væk fra kanalerne, der skabes en biomolekylær gradient. Denne gradient får de indlejrede cancerceller til at bevæge sig - ofte tilbage mod de simulerede blodkarkanaler.
Hos en patient, hvis kræftceller kommer ind i blodbanen, de metastaserer og kan danne sekundære cancertumorer. Ifølge LeDuc og Neumann, de fleste patienter med solide tumorer dør sædvanligvis af metastaser - ikke fra selve den primære tumor - hvilket er grunden til, at videnskabsmænd skal finde ud af, hvordan man stopper metastaser i at opstå i første omgang.
Metastaserende kræftceller har erhvervet evnen til at bevæge sig fra den primære tumor ind i blod- eller lymfesystemet - en proces, der kræver, at kræftceller migrerer og omformer tumorvævet for at invadere andre dele af kroppen. Så, for at stoppe metastaser, forskere har brug for at forstå, hvilke faktorer der understøtter kræftcellemobilitet og vævsremodellering. Dette er grunden til, at 3-D-systemet udviklet af LeDuc, Neumann, og Wan er så vigtig.
"Kræft er en ekstremt heterogen sygdom, hvilket betyder, at ikke kun kræftceller er forskellige fra patient til patient, de varierer selv inden for en tumor, " siger Neumann. "Det samme gælder for metastaser. Afhængigt af deres placering i kroppen, hver ekstra sekundær tumor er også forskellig."
For at bestemme den bedste behandling for hver patient, LeDuc, Neumann, og Wan mener, at forskere med tiden vil være i stand til at bruge deres system til at undersøge tumorer fra individuelle kræftpatienter. Denne proces vil i sidste ende hjælpe med at gøre kræftbehandling mere personlig og effektiv.
"Vores model kunne potentielt fungere som en patientspecifik model, " siger Wan, som udførte laboratorieforsøgene og analyserede resultaterne for denne undersøgelse. "Og det er meget vigtigt, fordi kræft er forskellig hos hver patient, hvilket gør det svært at helbrede."
Ideelt set 3D-systemet udviklet af LeDuc, Neumann, og Wan vil give forskere og videnskabsmænd de værktøjer, de har brug for, for at forhindre kræftceller i at sprede sig hos hver patient.
"I sidste ende, tumoren, der sidder der og laver ingenting - det er okay, " siger LeDuc. "Men så snart det går metastaserende, alt bryder løs. Vi håber, at vores system vil hjælpe med at stoppe metastaser og forbedre patientresultatet i det lange løb."
Teamets forskningspapir, med titlen "Mimicking Embedded Vasculature Structure for 3-D Cancer on a Chip Approaches through Micromilling, " blev offentliggjort i Videnskabelige rapporter . Ud over Philip LeDuc, Carola Neumann, og James Li Wan, maskiningeniør Ph.D. studerende Jonelle Yu, maskinteknik professor Burak Ozdoganlar (Carnegie Mellon University), og postdoc dr. John Skoko (University of Pittsburgh) bidrog til denne undersøgelse.
 Varme artikler
Varme artikler
-
 Maskinindlæringsmodel forudsiger fænomenets nøgle til forståelse af materielle egenskaberRobert Rudd, Timofey Frolov og Amit Samanta står foran en simulering af de topologiske atomer i et C2H4 -molekyle som defineret af kvanteteorien om atomer i molekyler (QTAIM) og beregnet ved hjælp af
Maskinindlæringsmodel forudsiger fænomenets nøgle til forståelse af materielle egenskaberRobert Rudd, Timofey Frolov og Amit Samanta står foran en simulering af de topologiske atomer i et C2H4 -molekyle som defineret af kvanteteorien om atomer i molekyler (QTAIM) og beregnet ved hjælp af -
 Grønt vandrensningssystem fungerer uden tungmetaller eller ætsende kemikalierDette billede viser en koncentrator, hvor prøver blev placeret. Kredit:Dan Wang Forskere ved Institute of Process Engineering (IPE) ved det kinesiske videnskabsakademi i Beijing og Yangzhou Univer
Grønt vandrensningssystem fungerer uden tungmetaller eller ætsende kemikalierDette billede viser en koncentrator, hvor prøver blev placeret. Kredit:Dan Wang Forskere ved Institute of Process Engineering (IPE) ved det kinesiske videnskabsakademi i Beijing og Yangzhou Univer -
 Præcis analyse af smogens partikelsammensætningDen analytiske teknik udviklet af de Warszawa-baserede forskere er en metode til at finde ud af om de fineste detaljer om den kemiske struktur af smogmolekyler. Kredit:IPC PAS, Grzegorz Krzyzewski
Præcis analyse af smogens partikelsammensætningDen analytiske teknik udviklet af de Warszawa-baserede forskere er en metode til at finde ud af om de fineste detaljer om den kemiske struktur af smogmolekyler. Kredit:IPC PAS, Grzegorz Krzyzewski -
 Intelligens, der kommer fra tilfældige polymernetværkStemmegenkendelse ved hjælp af sulfoneret polyanilin. Kredit:Creative Commons CC-BY, kredit:2021, Yuki Usami et al., Avancerede materialer Reservoir computing (RC) tackler komplekse problemer ved
Intelligens, der kommer fra tilfældige polymernetværkStemmegenkendelse ved hjælp af sulfoneret polyanilin. Kredit:Creative Commons CC-BY, kredit:2021, Yuki Usami et al., Avancerede materialer Reservoir computing (RC) tackler komplekse problemer ved
- Single-spin elektron paramagnetisk resonansspektrum med kilohertz spektral opløsning
- Jord har hemmeligheden bag at afbøde klimaforandringer
- Folkedrabets gerningsmænd siger, at de er gode mennesker
- Skift til vedvarende energi kan øge energifattigdom, undersøgelse finder
- Forsker bruger nanosilica til at styrke beton (m/ video)
- Alt du behøver at vide om Snapchat


