Hvordan opløses vandmolekyler i salt?
* Polaritet: Vandmolekyler (H₂O) er polære. Dette betyder, at de har en lidt positiv ende (brint) og en lidt negativ ende (ilt) på grund af ujævn deling af elektroner. Salt (NaCl, natriumchlorid) er en ionisk forbindelse, hvilket betyder, at den dannes af den elektrostatiske tiltrækning mellem positivt ladede natriumioner (Na⁺) og negativt ladede chloridioner (CL⁻).
* attraktion: Når salt tilsættes til vand, omgiver de polære vandmolekyler saltet. De positive ender af vandmolekyler tiltrækker de negativt ladede chloridioner, og de negative ender af vandmolekyler tiltrækker de positivt ladede natriumioner. Disse attraktioner overvinder de elektrostatiske kræfter, der holder natrium- og chloridioner sammen i saltkrystallen.
* dissociation: Vandmolekylerne trækker natrium- og chloridioner fra hinanden, hvilket får saltet til at dissociere i dets bestanddele. Disse ioner er nu omgivet af vandmolekyler, der danner en solveret ion og er frie til at bevæge sig rundt i vandet.
* opløste: Processen med saltkrystallen nedbrydes, og ionerne, der bliver omgivet af vandmolekyler, er det, vi kalder opløsning.
I det væsentlige tillader vandets polaritet det at bryde de ioniske bindinger i salt, adskille ionerne og danne en opløsning.
Her er en forenklet analogi: Forestil dig en gruppe mennesker, der holder hænder (saltkrystallen). Når vandmolekyler (med deres positive og negative ender) tilgang, trækker de på hænderne, hvilket får gruppen til at bryde fra hinanden. Nu er individerne (ionerne) omgivet af vandmolekyler, og de kan bevæge sig frit.
 Varme artikler
Varme artikler
-
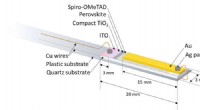 Lyser på, hvad der virkelig sker i perovskit-solcellerSkematisk struktur af elektriske kontakter og ledninger af perovskit-solcellen i et ESR-prøverør. Kredit:University of Tsukuba Forbrugere verden over efterspørger grønnere energikilder; derfor, op
Lyser på, hvad der virkelig sker i perovskit-solcellerSkematisk struktur af elektriske kontakter og ledninger af perovskit-solcellen i et ESR-prøverør. Kredit:University of Tsukuba Forbrugere verden over efterspørger grønnere energikilder; derfor, op -
 Fosforbaserede kompositter som anodematerialer til kalium-ion-batterierSkematisk illustration af de fosforbaserede kompositter som anodematerialer til KIBer. Kredit:WU Ying og HUANG Haibo Prof. WU Zhongshuai fra Dalian Institute of Chemical Physics (DICP) ved det kin
Fosforbaserede kompositter som anodematerialer til kalium-ion-batterierSkematisk illustration af de fosforbaserede kompositter som anodematerialer til KIBer. Kredit:WU Ying og HUANG Haibo Prof. WU Zhongshuai fra Dalian Institute of Chemical Physics (DICP) ved det kin -
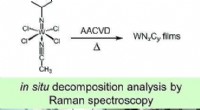 Simuleret kemisk dampaflejring fra en wolframcarbonitridforløberKredit: European Journal of Inorganic Chemistry Tynde film spiller en central rolle i produktionen af elektronik. De kan dyrkes direkte på en substratoverflade gennem processen med kemisk dampa
Simuleret kemisk dampaflejring fra en wolframcarbonitridforløberKredit: European Journal of Inorganic Chemistry Tynde film spiller en central rolle i produktionen af elektronik. De kan dyrkes direkte på en substratoverflade gennem processen med kemisk dampa -
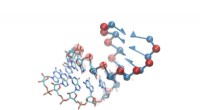 Opdagelse af strukturen af RNAEn ny undersøgelse udvikler en innovativ simuleringsmodel, der effektivt kan forudsige konformationen af ribonukleinsyremolekyler, åbne op for interessante muligheder for ansøgning og forskning Kred
Opdagelse af strukturen af RNAEn ny undersøgelse udvikler en innovativ simuleringsmodel, der effektivt kan forudsige konformationen af ribonukleinsyremolekyler, åbne op for interessante muligheder for ansøgning og forskning Kred
- Hvorfor varme og arbejde er vejfunktion bevist?
- Hvornår kan Orion ses på jorden?
- Polyoxometalater viser lovende som lægemiddeltransportere ind i cellen
- Undersøgelse analyserede skatteaftaler for at vurdere effekten af offshoring på indenlandsk besk…
- Kroppsdele af en krokodille
- Leverer medicin til tiden og til målet


