Hvad er formlen for at finde elektrokemisk ækvivalent?
ece =(molmasse af stoffet) / (Faradays konstante * antal overførte elektroner)
hvor:
* ECE: Elektrokemisk ækvivalent (i gram pr. Coulomb, G/C)
* molmasse: Stoffets molære masse (i gram pr. Mol, g/mol)
* Faradays konstant: Ladningen af en mol elektroner (ca. 96.485 coulombs pr. Mol, c/mol)
* Antal overførte elektroner: Antallet af elektroner involveret i halvreaktionen af stoffet under elektrolyse.
Eksempel:
Lad os beregne kobberens ECE (Cu).
* molmasse Cu: 63,55 g/mol
* Faradays konstant: 96.485 c/mol
* Antal overførte elektroner: 2 (cu²⁺ + 2e⁻ → Cu)
ECE af Cu =(63,55 g/mol)/(96,485 c/mol * 2) =0,000329 g/c
Derfor er det elektrokemiske ækvivalent med kobber 0,000329 gram pr. Coulomb.
Vigtige noter:
* Antallet af elektroner, der er overført i halvreaktionen, er afgørende for bestemmelse af ECE.
* Det elektrokemiske ækvivalent er en grundlæggende konstant for et givet stof og er uafhængig af den nuværende, tid eller andre faktorer.
* ECE kan bruges til at beregne mængden af stof, der er deponeret eller befriet under elektrolyse.
 Varme artikler
Varme artikler
-
 Spiropyran-funktionaliserede fotokromiske nylonbånd til langtidsføling af ultraviolet lys(a) Snapshots af SP-funktionaliserede webbings over otte ugers UV-eksponering. (b) Tidsmæssig udvikling af webbingsets farve repræsenteret i CIE 1976-farverummet. Indsatsen er en zoomet visning, og de
Spiropyran-funktionaliserede fotokromiske nylonbånd til langtidsføling af ultraviolet lys(a) Snapshots af SP-funktionaliserede webbings over otte ugers UV-eksponering. (b) Tidsmæssig udvikling af webbingsets farve repræsenteret i CIE 1976-farverummet. Indsatsen er en zoomet visning, og de -
 Nye biokompatible hybridhydrogeler med imponerende mekaniske egenskaberFigur 1:SAXS -opsætningen på I22. Kredit:Diamond lyskilde For første gang er der skabt en familie af hydrogeler, med unikke egenskaber, der gør det muligt at bruge dem i biologiske applikationer.
Nye biokompatible hybridhydrogeler med imponerende mekaniske egenskaberFigur 1:SAXS -opsætningen på I22. Kredit:Diamond lyskilde For første gang er der skabt en familie af hydrogeler, med unikke egenskaber, der gør det muligt at bruge dem i biologiske applikationer. -
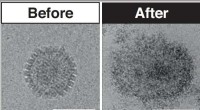 Unik ny antiviral behandling fremstillet ved hjælp af sukkerVirucidbehandling før og efter. Kredit:University of Manchester Nye antivirale materialer fremstillet af sukker er udviklet til at ødelægge vira ved kontakt og kan hjælpe i kampen mod virusudbrud.
Unik ny antiviral behandling fremstillet ved hjælp af sukkerVirucidbehandling før og efter. Kredit:University of Manchester Nye antivirale materialer fremstillet af sukker er udviklet til at ødelægge vira ved kontakt og kan hjælpe i kampen mod virusudbrud. -
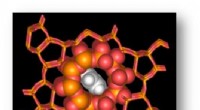 Forskere opdager nye byggesten i katalysatorzeolit -nanoporerUMass Amherst kemikere og materialeforskere har avanceret forståelse af zeolitkatalysatorstruktur og vibrationer for at hjælpe med at føre til nye materialer til ren energi og kulstofopsamling, blandt
Forskere opdager nye byggesten i katalysatorzeolit -nanoporerUMass Amherst kemikere og materialeforskere har avanceret forståelse af zeolitkatalysatorstruktur og vibrationer for at hjælpe med at føre til nye materialer til ren energi og kulstofopsamling, blandt
- Hvilken lov om termodynamik er grunden til, at du har brug for en konstant inputenergi til at drive …
- Hvad svarer Vernal Equinox på himmelsk sfære til geografiske kort?
- Hvad er det sidste lag jord dannet?
- Forskere udvikler en sort fosforfibre i alle fibre
- Forskere banebrydende brug af dyb læring til opdagelse af gravitationsbølger i realtid
- Sådan laver du et fraktionskvivalentdiagram


