Hvorfor bliver kobbersulfatopløsning klar, og magnesium udvikler en belægning?
reaktionen:
Når du placerer et stykke magnesiummetal i en kobbersulfatopløsning, opstår følgende reaktion:
mg (s) + cuso₄ (aq) → mgso₄ (aq) + cu (s)
Forklaring:
1. magnesium er mere reaktiv end kobber: Magnesium er højere på reaktivitetsserien end kobber. Det betyder, at det er mere sandsynligt, at det mister elektroner og danner positive ioner.
2. forskydning: Magnesiumatomer (Mg) fortrænger kobberionerne (Cu²⁺) fra kobbersulfatopløsningen (CUSO₄).
3. Dannelse af magnesiumsulfat: Magnesiumionerne (mg²⁺) kombineres derefter med sulfationer (SO₄²⁻) for at danne magnesiumsulfat (MGSO₄), der opløses i vandet.
4. Kobberaflejring: De fordrevne kobberioner (Cu²⁺) får elektroner og bliver faste kobberatomer (Cu), der belægger magnesiummetal.
Observationer:
* Blå kobbersulfatopløsning bliver klar: Den blå farve på kobbersulfatopløsningen kommer fra kobberionerne (Cu²⁺). Når kobberionerne forskydes og danner fast kobber, mister opløsningen sin blå farve og bliver klar.
* magnesium udvikler en belægning: De faste kobberatomer, der er afsat på magnesiummetal, danner en rødbrun belægning.
Kortfattet: Reaktionen er drevet af den større reaktivitet af magnesium, hvilket fører til forskydning af kobberioner fra opløsningen og dannelsen af en kobberbelægning på magnesium.
Sidste artikelHvad er formlen for at finde elektrokemisk ækvivalent?
Næste artikelHvad er eksempler på fissionsreaktanter?
 Varme artikler
Varme artikler
-
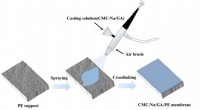 Pervaporationsmembraner viser løfte om genvinding af alkalisk spildevandEn (CMC-Na/GA)/PE-kompositmembran blev fremstillet ved spray-coating og viste fremragende egenskaber til alkalisk vandgenvinding. Kredit:Jianzhong Xia, Pei Li Industrielle processer genererer ofte
Pervaporationsmembraner viser løfte om genvinding af alkalisk spildevandEn (CMC-Na/GA)/PE-kompositmembran blev fremstillet ved spray-coating og viste fremragende egenskaber til alkalisk vandgenvinding. Kredit:Jianzhong Xia, Pei Li Industrielle processer genererer ofte -
 Computermodel afslører effekten af øget kolesterol på specifik ionkanal i hjertetSet ovenfra og ned af den åbne Kir2-kaliumkanal, fremhæver den pore, som ioner bevæger sig igennem. Kredit:Nicolas Barbera Ved hjælp af en computermodel, forskere fra North Carolina State Universi
Computermodel afslører effekten af øget kolesterol på specifik ionkanal i hjertetSet ovenfra og ned af den åbne Kir2-kaliumkanal, fremhæver den pore, som ioner bevæger sig igennem. Kredit:Nicolas Barbera Ved hjælp af en computermodel, forskere fra North Carolina State Universi -
 At finde nye anvendelser for affaldsdækScrap Tire-programmet kombinerede ressourcer og ekspertise fra den akademiske verden og regeringen i staten Delaware i håb om at afbøde et problem, der kan skade miljøet og mennesker. Kredit:Universit
At finde nye anvendelser for affaldsdækScrap Tire-programmet kombinerede ressourcer og ekspertise fra den akademiske verden og regeringen i staten Delaware i håb om at afbøde et problem, der kan skade miljøet og mennesker. Kredit:Universit -
 Ser man på en fremtid, hvor afisning af fly hører fortiden tilKredit:Alexey Lesik, Shutterstock Ved hjælp af nanoteknologi, forskere skaber nye flybelægninger, der afviser vand og forhindrer dannelse af is. Når is ophobes på flyoverflader, det forstyrrer fl
Ser man på en fremtid, hvor afisning af fly hører fortiden tilKredit:Alexey Lesik, Shutterstock Ved hjælp af nanoteknologi, forskere skaber nye flybelægninger, der afviser vand og forhindrer dannelse af is. Når is ophobes på flyoverflader, det forstyrrer fl
- Hvorfor ser det ud til, at mønstrene af stjerner skifter lidt vestover fra aftenen?
- Hvor mange ammoniumioner NH4 er der i 5,0 mol (NH4)2S?
- Skyer er smukkere på vinterdage end sommer en dårlig hypotese, fordi hvad?
- Hylder blottet som Irma tønder mod Miami
- SpaceX klar til at sende astronauter ud i rummet for første gang
- Hvilken del af hjernen kommer kognition fra?


