Hvorfor danner ædle gasser ikke forbindelser under almindelige omstændigheder?
* fuld ydre skal: Ædle gasser har en komplet yderste elektronskal. Dette betyder, at de har det maksimale antal elektroner, som deres yderste skal kan holde, hvilket gør dem meget stabile.
* Høj ioniseringsenergi: Ædle gasser kræver meget energi for at fjerne en elektron fra deres ydre skal. Dette gør det meget vanskeligt for dem at danne positive ioner (kationer).
* Lav elektronaffinitet: Ædle gasser har ringe tendens til at få et elektron. Dette gør det usandsynligt for dem at danne negative ioner (anioner).
Disse faktorer gør det ekstremt vanskeligt for ædle gasser at deltage i kemiske reaktioner under almindelige forhold. De er i det væsentlige tilfredse med deres stabile elektroniske konfiguration og interagerer ikke let med andre elementer for at danne forbindelser.
Undtagelser:
Mens ædle gasser generelt er ureaktive, findes der nogle undtagelser:
* xenon: Xenon, den største og tyngste ædle gas, har vist sig at danne forbindelser med stærkt elektronegative elementer som fluor og ilt. Eksempler inkluderer XEF 2 (Xenon difluorid) og Xeo 3 (Xenon Trioxid).
* Andre ædle gasser: Andre ædle gasser, som Krypton og Radon, har også vist sig at danne forbindelser under specifikke forhold. Disse forbindelser er generelt ustabile og vanskelige at syntetisere.
Kortfattet: Noble gasser danner ikke forbindelser under almindelige omstændigheder, fordi de har en fuld ydre skal af elektroner, hvilket gør dem ekstremt stabile. Under specifikke forhold kan nogle tungere ædle gasser imidlertid danne forbindelser med stærkt elektronegative elementer.
Sidste artikelHvad er den kemiske formel dannet mellem kobolt (III) og bromidion?
Næste artikelNår en væske opvarmes stærkt dens densitet?
 Varme artikler
Varme artikler
-
 Brug af lignin til at erstatte fossile materialerForskningen og udnyttelsen af kuglelignende ligninpartikler er stadig ny, men produktionen er allerede mulig i partier på flere kilo. Det gør det muligt at teste dem i forskellige applikationer, sig
Brug af lignin til at erstatte fossile materialerForskningen og udnyttelsen af kuglelignende ligninpartikler er stadig ny, men produktionen er allerede mulig i partier på flere kilo. Det gør det muligt at teste dem i forskellige applikationer, sig -
 Ny metode giver første kig på superkolde kulstofmolekylerDr. Willliam Lewis, AFRL Senior Research Chemist med Turbine Engine Division, Aerospace Systems Directorate, konfigurerer laseren til at scanne et infrarødt spektrum for Cluster Assembly og Spectrosco
Ny metode giver første kig på superkolde kulstofmolekylerDr. Willliam Lewis, AFRL Senior Research Chemist med Turbine Engine Division, Aerospace Systems Directorate, konfigurerer laseren til at scanne et infrarødt spektrum for Cluster Assembly og Spectrosco -
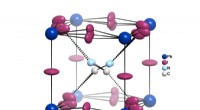 Perovskite solceller:Mulige aspekter af høj effektivitet afdækketTegningen illustrerer vekselvirkningen af den organiske methylammoniumkation (CH3NH3+) med de omgivende iodidioner. Skiftet af iodidatomerne ud af det fælles plan med bly forårsager brud på inversio
Perovskite solceller:Mulige aspekter af høj effektivitet afdækketTegningen illustrerer vekselvirkningen af den organiske methylammoniumkation (CH3NH3+) med de omgivende iodidioner. Skiftet af iodidatomerne ud af det fælles plan med bly forårsager brud på inversio -
 Ingeniører producerer langvarig, energitæthed batteriEt kig inde i energitætheden mangandioxid-zinkbatteri udviklet på CCNY. Kredit:City College i New York En ny generation af mangandioxid-zinkbatterier med hidtil uset cyklusliv og energitæthed er d
Ingeniører producerer langvarig, energitæthed batteriEt kig inde i energitætheden mangandioxid-zinkbatteri udviklet på CCNY. Kredit:City College i New York En ny generation af mangandioxid-zinkbatterier med hidtil uset cyklusliv og energitæthed er d
- Er din kaffe ikke varm eller kold? At observere, hvordan hjernen behandler negerede adjektiver
- Hvilken metode bruges til at opnå mineralaflejringen placeret lige under jordoverfladen?
- Excentriciteten af en bane beskriver?
- Hvor mange miles lig med 310 nm?
- Enzymcocktail udviklet i Brasilien driver produktionen af anden generations ethanol
- Edderkoppesilke kunne bruges som robotmuskel


