Hvad er tættere hårdere har højere smeltepunkter og lidt mindre aktive end alkalimetaller i samme periode?
* tættere: Alkaliske jordmetaller er tættere end alkalimetaller, fordi de har en mindre atomradius og et større antal protoner i deres kerne, hvilket fører til en stærkere attraktion mellem kernen og elektronerne.
* hårdere: Den stærkere metalliske binding i alkaliske jordmetaller gør dem sværere end alkalimetaller.
* Højere smeltepunkter: Den stærkere metalliske binding bidrager også til højere smeltepunkter for alkaliske jordmetaller.
* lidt mindre aktiv: Alkaliske jordmetaller har en lavere reaktivitet end alkalimetaller. Dette skyldes, at de har to valenselektroner, som er mindre let fjernet end den enkelte valenselektron af alkalimetaller.
Eksempler på alkaliske jordmetaller inkluderer:
* Beryllium (BE)
* Magnesium (mg)
* Calcium (CA)
* Strontium (SR)
* Barium (BA)
* Radium (RA)
Fortæl mig, hvis du gerne vil vide mere om nogen af disse egenskaber!
 Varme artikler
Varme artikler
-
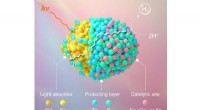 Voksende aktive steder på kvanteprikker til robust brintfotogenereringSkematisk diagram over sted- og rumligt-selektiv integration af metalioner i QDer for robust H 2 fotogenerering. Kredit:Prof. WUs Group For ganske nylig, Kinesiske forskere havde opnået sted- og
Voksende aktive steder på kvanteprikker til robust brintfotogenereringSkematisk diagram over sted- og rumligt-selektiv integration af metalioner i QDer for robust H 2 fotogenerering. Kredit:Prof. WUs Group For ganske nylig, Kinesiske forskere havde opnået sted- og -
 Forskere finder en ny opbevaringsmekanisme for opladningKredit:Pixabay/CC0 Public Domain Forskning mellem University of Liverpool, Storbritannien og National Tsing Hua University (NTHU), Taiwan har afsløret en ny opladningsmekanisme, der har potentiale
Forskere finder en ny opbevaringsmekanisme for opladningKredit:Pixabay/CC0 Public Domain Forskning mellem University of Liverpool, Storbritannien og National Tsing Hua University (NTHU), Taiwan har afsløret en ny opladningsmekanisme, der har potentiale -
 Hvidere tænder, uden forbrændingenKredit:CC0 Public Domain De fleste mennesker vil gerne fremvise et smil af perlehvide, men med tiden kan tænder blive plettet af mad, drikkevarer og nogle medicin. Desværre, de høje niveauer af hy
Hvidere tænder, uden forbrændingenKredit:CC0 Public Domain De fleste mennesker vil gerne fremvise et smil af perlehvide, men med tiden kan tænder blive plettet af mad, drikkevarer og nogle medicin. Desværre, de høje niveauer af hy -
 Metode til at forudsige lægemiddelstabilitet kan føre til mere effektive lægemidlerKredit:Gatis Gribusts/Flickr Forskere fra Storbritannien og Danmark har udviklet en ny metode til at forudsige den fysiske stabilitet af lægemiddelkandidater, som kunne hjælpe med udviklingen af
Metode til at forudsige lægemiddelstabilitet kan føre til mere effektive lægemidlerKredit:Gatis Gribusts/Flickr Forskere fra Storbritannien og Danmark har udviklet en ny metode til at forudsige den fysiske stabilitet af lægemiddelkandidater, som kunne hjælpe med udviklingen af
- Ulemperne ved gelelektroforese
- Hvad kalder du formationer, der hænger fra et hules loft?
- Er en Star Convverse Real Converse?
- Hvorfor forskere er interesserede i at holde (nogle) løvefisk sunde
- Forskere finder en måde at fremskynde DNA-overfladehybridisering
- COVID-19 ramte aktiemarkederne, da den spredte sig fra land til land


