Hvad er katalysator, der giver brug for det?
Hvad er en katalysator?
En katalysator er et stof, der fremskynder hastigheden for en kemisk reaktion uden at blive fortæret i processen. Det fungerer ved at tilvejebringe en alternativ reaktionsvej med en lavere aktiveringsenergi , hvilket tillader reaktionen at fortsætte hurtigere.
Tænk på det som et "hjælper" -molekyle, der letter reaktionen uden at blive ændret selv.
Anvendelser af katalysatorer:
Katalysatorer er vigtige i mange aspekter af vores liv og bruges i forskellige brancher. Her er nogle nøgleeksempler:
1. Kemisk industri:
* Produktion af plast, gødning og farmaceutiske stoffer: Katalysatorer bruges til at syntetisere mange essentielle kemikalier, hvilket gør dem mere effektive og miljøvenlige.
* Petroleumraffinering: Katalysatorer hjælper med at nedbryde store carbonhydridmolekyler i mindre, mere nyttige produkter som benzin og dieselbrændstof.
* Produktion af ammoniak: Haber-Bosch-processen, der bruger en katalysator til at producere ammoniak, er afgørende for at producere gødning og andre nitrogenholdige forbindelser.
2. Miljøbeskyttelse:
* katalytiske omformere i biler: Disse enheder bruger katalysatorer til at omdanne skadelige forurenende stoffer som kulilte, kulbrinter og nitrogenoxider til mindre skadelige stoffer som kuldioxid, vand og nitrogengas.
* spildevandsbehandling: Katalysatorer kan hjælpe med at forringe forurenende stoffer i spildevand, hvilket gør det mere sikkert at udskrive tilbage i miljøet.
3. Biologiske systemer:
* enzymer: Enzymer er biologiske katalysatorer, der fremskynder essentielle biokemiske reaktioner i levende organismer, såsom fordøjelse, respiration og DNA -replikation.
4. Energiproduktion:
* brændselsceller: Katalysatorer er afgørende for at lette de elektrokemiske reaktioner i brændselsceller, der omdanner kemisk energi direkte til elektrisk energi.
* vedvarende energi: Katalysatorer kan bruges til at forbedre effektiviteten af solceller og andre vedvarende energiteknologier.
Typer af katalysatorer:
* homogene katalysatorer: Katalysatorer, der er i den samme fase (faste, flydende eller gas) som reaktanterne.
* heterogene katalysatorer: Katalysatorer, der er i en anden fase end reaktanterne (f.eks. Fast katalysator i en flydende eller gasreaktion).
* biokatalysatorer (enzymer): Katalysatorer afledt af biologiske kilder.
Betydningen af katalysatorer:
* øgede reaktionshastigheder: Katalysatorer gør det muligt for reaktioner at fortsætte hurtigere, øge effektiviteten og produktiviteten.
* reduceret energiforbrug: Katalysatorer sænker aktiveringsenergien, hvilket reducerer behovet for høje temperaturer eller tryk.
* Forbedret selektivitet: Katalysatorer kan favorisere produktionen af ønskede produkter og minimere dannelsen af uønskede biprodukter.
* Miljøfordele: Katalysatorer kan reducere forurening og fremme bæredygtige kemiske processer.
Katalysatorer er en kritisk del af mange moderne teknologier og spiller en afgørende rolle i en lang række industrier. Deres evne til at fremskynde reaktioner og forbedre effektiviteten har gjort dem til uundværlige værktøjer til at fremme videnskab, teknologi og vores forståelse af verden omkring os.
 Varme artikler
Varme artikler
-
 Ozon nedbryder THC aflejret på overflader fra tredjehånds cannabisrøgKredit:CC0 Public Domain Anden og tredjehånds tobaksrøg har fået masser af opmærksomhed, men meget mindre er kendt om de forbindelser, der aflejres på overflader fra cannabisrøg. Nu, forskere, der
Ozon nedbryder THC aflejret på overflader fra tredjehånds cannabisrøgKredit:CC0 Public Domain Anden og tredjehånds tobaksrøg har fået masser af opmærksomhed, men meget mindre er kendt om de forbindelser, der aflejres på overflader fra cannabisrøg. Nu, forskere, der -
 Forskere finder potente kemiske midler, der kan forhindre kræftmetastaserMaurizio Pellecchia fra UC Riverside i laboratoriet. Kredit:Carrie Rosema For nylig, et forskerhold ledet af Maurizio Pellecchia ved University of California, Riverside, opdaget en måde, hvorpå ke
Forskere finder potente kemiske midler, der kan forhindre kræftmetastaserMaurizio Pellecchia fra UC Riverside i laboratoriet. Kredit:Carrie Rosema For nylig, et forskerhold ledet af Maurizio Pellecchia ved University of California, Riverside, opdaget en måde, hvorpå ke -
 Forskere opnår højentropi carbid i elektrisk lysbueplasmaKredit:Tomsk Polytekniske Universitet Forskere fra Tomsk Polytechnic University har syntetiseret højentropi carbid bestående af fem forskellige metaller ved hjælp af en vakuumfri elektrisk lysbuem
Forskere opnår højentropi carbid i elektrisk lysbueplasmaKredit:Tomsk Polytekniske Universitet Forskere fra Tomsk Polytechnic University har syntetiseret højentropi carbid bestående af fem forskellige metaller ved hjælp af en vakuumfri elektrisk lysbuem -
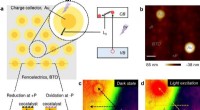 Forskere foreslår ny ladningsadskillelsesstrategi i ferroelektriske fotokatalysatorerLadningsadskillelse ved meta/ferroelektrisk grænseflade. et skematisk diagram af foreslået metal/ferroelektrisk fotokatalysator. b AFM-topografi af Au-partikler på en BaTiO3 enkelt krystal. Målestok,
Forskere foreslår ny ladningsadskillelsesstrategi i ferroelektriske fotokatalysatorerLadningsadskillelse ved meta/ferroelektrisk grænseflade. et skematisk diagram af foreslået metal/ferroelektrisk fotokatalysator. b AFM-topografi af Au-partikler på en BaTiO3 enkelt krystal. Målestok,
- Hvilke temperaturer brænder tænderne på?
- Virksomheden kan ikke længere ignorere ekstreme varmebegivenheder. Det er ved at blive en fare for …
- Oplysninger om polarzonen
- At forstå kulturelle forskelle kan styrke et multikulturelt team
- Rød lækkert eller ulveæble? Brasilianske savannefrugter med højt indhold af antioxidanter
- Sundhedseffekten af støtte mellem afroamerikanske par, når de beskæftiger sig med racediskrimin…


