Hvad er tiltrækningen mellem en let positiv ladning på brintatom og negativt for nærliggende A?
Her er en sammenbrud:
* Hydrogenbinding: En speciel type dipol-dipolinteraktion, hvor et hydrogenatom kovalent knyttet til et stærkt elektronegativt atom (som ilt, nitrogen eller fluor) tiltrækkes af et elektronpar af et andet stærkt elektronegativt atom.
* let positiv ladning på brint: Det stærkt elektronegative atom trækker de delte elektroner i den kovalente binding tættere på sig selv, hvilket skaber en delvis negativ ladning (Δ-) på det atom og en delvis positiv ladning (δ+) på hydrogenatomet.
* negativt for nærliggende atom: Det delvist positive hydrogenatom tiltrækkes derefter af det ensomme par elektroner på et nærliggende elektronegativt atom, hvilket skaber en svag interaktion kendt som en hydrogenbinding.
Nøglepunkter:
* stærkere end van der Waals Forces: Hydrogenbindinger er stærkere end regelmæssige dipol-dipol-interaktioner og van der Waals-kræfter, men de er svagere end kovalente bindinger.
* Vigtigt for mange biologiske processer: Hydrogenbindinger spiller en afgørende rolle i mange biologiske processer, såsom:
* Holde DNA -strenge sammen
* Stabilisering af proteiner
* Fremme af Water's unikke egenskaber (højt kogepunkt, høj overfladespænding)
Fortæl mig, hvis du vil lære mere om hydrogenbinding!
 Varme artikler
Varme artikler
-
 Implantatinfektioner kan forvises takket være stilladsgennembrudEscherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH Forskere i Irland har taget et stort skridt fremad i kampen mod medicinske implantatinfektioner. De udviklede en ny type implantat
Implantatinfektioner kan forvises takket være stilladsgennembrudEscherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH Forskere i Irland har taget et stort skridt fremad i kampen mod medicinske implantatinfektioner. De udviklede en ny type implantat -
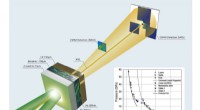 En stødinduceret mekanisme til oprettelse af organiske molekylerEksperimentel konfiguration af laserdrevne chokkomprimeringsforsøg på benzen. Kredit:Los Alamos National Laboratory Komplekse kulstofbaserede molekyler er overalt i kosmos. Hvor mange af disse mol
En stødinduceret mekanisme til oprettelse af organiske molekylerEksperimentel konfiguration af laserdrevne chokkomprimeringsforsøg på benzen. Kredit:Los Alamos National Laboratory Komplekse kulstofbaserede molekyler er overalt i kosmos. Hvor mange af disse mol -
 AI -algoritme identificerer ny forbindelse, der potentielt kan bruges til fotoniske enheder, biologi…Kredit:CC0 Public Domain Når ordene kunstig intelligens (AI) kommer til at tænke på, dine første tanker kan være super-smarte computere, eller robotter, der udfører opgaver uden at have brug for h
AI -algoritme identificerer ny forbindelse, der potentielt kan bruges til fotoniske enheder, biologi…Kredit:CC0 Public Domain Når ordene kunstig intelligens (AI) kommer til at tænke på, dine første tanker kan være super-smarte computere, eller robotter, der udfører opgaver uden at have brug for h -
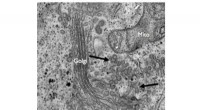 Enzym har vist sig at kontrollere dannelsen af kollagenbærere og hæmme kollagensekretionElektronmikroskopi-billeddannelse afslører tilstedeværelsen af mange indbyrdes forbundne vesikler, som ser ud til at opføre sig som kollagenbærere (angivet med pile). Kredit: Biokemisk og biofysisk
Enzym har vist sig at kontrollere dannelsen af kollagenbærere og hæmme kollagensekretionElektronmikroskopi-billeddannelse afslører tilstedeværelsen af mange indbyrdes forbundne vesikler, som ser ud til at opføre sig som kollagenbærere (angivet med pile). Kredit: Biokemisk og biofysisk
- race, etnisk mangfoldighed i skolerne påvirker mental sundhed
- Forsyner bærbare enheder med højtydende carbon nanorør-garn
- 360 grader, 180 sekunder:Ny teknik hastighedsanalyse af afgrødeegenskaber
- Undersøgelse viser, at grafen er i stand til at modstå en fartkugle
- Opgive gas:Chinas Shenzhen skifter til elektriske taxaer
- Forskere udvikler nyt ultrahurtigt 3D-mikroskop


