Når den fysiske tilstand af et stof ændres i fase, hvad sker der med temperatursystemet?
Her er hvorfor:
* faseovergange kræver energi: Ændring af stofstilstanden (f.eks. Fra fast til væske eller væske til gas) kræver energi til at bryde eller danne intermolekylære bindinger.
* Energi går i ændring af staten, ikke temperatur: Den tilsatte eller fjernede varmeenergi bruges til at overvinde kræfterne, der holder molekylerne sammen, snarere end at øge deres kinetiske energi (hvilket ville hæve temperaturen).
* konstant temperatur under overgangen: Under faseovergangen forbliver temperaturen konstant, selvom der tilsættes varme. Dette skyldes, at energien bruges til at bryde eller danne bindinger, ikke til at øge temperaturen.
Eksempler:
* Meltis: Is absorberer varmeenergi, når den smelter i vandet, men dens temperatur forbliver ved 0 ° C (32 ° F), indtil al isen er smeltet.
* kogende vand: Vand absorberer varmeenergi, når den koger i damp, men dens temperatur forbliver ved 100 ° C (212 ° F), indtil alt vandet er kogt væk.
Key Takeaway: Faseovergange er isotermiske processer, hvilket betyder, at de forekommer ved en konstant temperatur.
Sidste artikelHvilke kemiske elementer findes i varm sauce?
Næste artikelHvor mange H -atomer i 1 mol C7H16?
 Varme artikler
Varme artikler
-
 Ny tilgang gør det lettere at finde nye lægemidlerBåndrepræsentation af strukturen af et enzym kendt som ATP-PRT fra TB-bakterier (blå), bundet til en allosterisk aktivator (pink). Kredit:Luiz Carvalho Forskere har skabt en ny metode til screen
Ny tilgang gør det lettere at finde nye lægemidlerBåndrepræsentation af strukturen af et enzym kendt som ATP-PRT fra TB-bakterier (blå), bundet til en allosterisk aktivator (pink). Kredit:Luiz Carvalho Forskere har skabt en ny metode til screen -
 En speciel elementær magiProtoner har forskellige stabile magiske tal:2, 8, 20, 28, og så videre. Når nukleare baner er fyldt med protoner, de danner stabile kerner, analogt med ædelgaselementerne Kredit:Kyoto University/Yosh
En speciel elementær magiProtoner har forskellige stabile magiske tal:2, 8, 20, 28, og så videre. Når nukleare baner er fyldt med protoner, de danner stabile kerner, analogt med ædelgaselementerne Kredit:Kyoto University/Yosh -
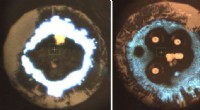 Forskere syntetiserer nyt nitrid og stabiliserer dets hexazinringe ved højt trykMikrofotografier af laseropvarmede kaliumazidprøver ved tryk på 500.000 atmosfærer (venstre) og 300.000 atmosfærer (højre). De hvide til lyseblå områder på ydersiden er K1N3. Mod midten er materialet
Forskere syntetiserer nyt nitrid og stabiliserer dets hexazinringe ved højt trykMikrofotografier af laseropvarmede kaliumazidprøver ved tryk på 500.000 atmosfærer (venstre) og 300.000 atmosfærer (højre). De hvide til lyseblå områder på ydersiden er K1N3. Mod midten er materialet -
 Fysikere opdager en tri-anion partikel med kolossal stabilitetKredit:Virginia Commonwealth University Forskere fra Virginia Commonwealth University har opnået en bedrift, der er den første inden for fysik og kemi-en der kunne have vidtrækkende anvendelser.
Fysikere opdager en tri-anion partikel med kolossal stabilitetKredit:Virginia Commonwealth University Forskere fra Virginia Commonwealth University har opnået en bedrift, der er den første inden for fysik og kemi-en der kunne have vidtrækkende anvendelser.


