Hvad sker der med hastigheden af en kemisk reaktion, når katalysator er til stede?
* sænkning af aktiveringsenergi: Katalysatorer giver en alternativ reaktionsvej med en lavere aktiveringsenergi. Dette betyder, at der er behov for mindre energi for reaktanterne til at nå overgangstilstanden og danne produkter.
* Forøgelse af reaktionshastigheden: Ved at sænke aktiveringsenergien tillader katalysatorer flere reaktantmolekyler at overvinde energibarrieren og reagere, hvilket fører til en hurtigere reaktionshastighed.
Tænk på det sådan:Forestil dig et bjergpas. Reaktanterne er nødt til at klatre op på bjerget for at nå produktsiden. En katalysator er som at bygge en tunnel gennem bjerget, hvilket gør det meget lettere og hurtigere for reaktanterne at komme til den anden side.
Vigtige punkter:
* Katalysatorer forbruges ikke i reaktionen. De deltager i reaktionen, men regenereres i slutningen.
* Katalysatorer kan være specifikke for visse reaktioner og kan bruges i forskellige former (faste stoffer, væsker, gasser).
* Tilstedeværelsen af en katalysator ændrer ikke ligevægtskonstanten (K) af en reaktion. Det hjælper simpelthen reaktionen med at nå ligevægt hurtigere.
Eksempler på katalysatorer:
* enzymer: Biologiske katalysatorer, der fremskynder biokemiske reaktioner i levende organismer.
* metalkatalysatorer: Brugt i mange industrielle processer, såsom produktion af benzin og plast.
* syrekatalysatorer: Brugt i mange organiske reaktioner, såsom esterificering.
Sammenfattende er katalysatorer kraftfulde værktøjer, der kan øge hastigheden af kemiske reaktioner. De er vigtige i mange industrielle og biologiske processer.
Sidste artikelHvad er udtrykkatalysator introduceret af?
Næste artikelHvad vil det ændre at tilføje en katalysator til kemisk reaktion?
 Varme artikler
Varme artikler
-
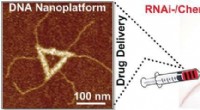 DNA origami fuld af potente kræftfremkaldende midlerKredit:Wiley En af de mest succesfulde teknikker til bekæmpelse af multilægemiddelresistens i kræftceller er nedregulering af de gener, der er ansvarlige for lægemiddelresistens. Kinesiske forsker
DNA origami fuld af potente kræftfremkaldende midlerKredit:Wiley En af de mest succesfulde teknikker til bekæmpelse af multilægemiddelresistens i kræftceller er nedregulering af de gener, der er ansvarlige for lægemiddelresistens. Kinesiske forsker -
 Ny katalysator hjælper med at omdanne kuldioxid til brændstofAisulu Aitbekova, venstre, og Matteo Cargnello foran reaktoren, hvor Aitbekova udførte mange af eksperimenterne til dette projekt. Kredit:L.A. Cicero Forestil dig at få fat i kuldioxid fra bilers
Ny katalysator hjælper med at omdanne kuldioxid til brændstofAisulu Aitbekova, venstre, og Matteo Cargnello foran reaktoren, hvor Aitbekova udførte mange af eksperimenterne til dette projekt. Kredit:L.A. Cicero Forestil dig at få fat i kuldioxid fra bilers -
 Krystaløer kan halvere tid og omkostninger ved videnskabelige eksperimenterEn siliciumprøve renses med høj temperatur, i et Omicron VT-AFM/XA multifunktionssystem. Kredit:QUT QUT-forskere har fundet en måde at dyrke krystaløer på, som kan halvere tiden og omkostningerne
Krystaløer kan halvere tid og omkostninger ved videnskabelige eksperimenterEn siliciumprøve renses med høj temperatur, i et Omicron VT-AFM/XA multifunktionssystem. Kredit:QUT QUT-forskere har fundet en måde at dyrke krystaløer på, som kan halvere tiden og omkostningerne -
 Hvorfor et nysgerrigt krebsdyr kunne holde hemmeligt for at lave vedvarende energi fra træGribble på et stykke træ. Kredit:Claire Steele-King og Katrin Besser, University of York Forskere, der studerer fordøjelsessystemet hos et nysgerrigt træædende krebsdyr, har opdaget, at det kan væ
Hvorfor et nysgerrigt krebsdyr kunne holde hemmeligt for at lave vedvarende energi fra træGribble på et stykke træ. Kredit:Claire Steele-King og Katrin Besser, University of York Forskere, der studerer fordøjelsessystemet hos et nysgerrigt træædende krebsdyr, har opdaget, at det kan væ
- Vandområder i Løvskoven
- Hvilken kirtel indleder væksten og andre fysiske ændringer i ungdomsårene?
- Ændring af farven på laserlys på femtosekunders tidsskala
- Dødstallet fra oversvømmelser i Venezuela stiger til otte
- Hvorfor vulkanen Mount Nyiragongo brød ud med ringe eller ingen advarsel
- Fem tips fra NASA til fotografering af den totale solformørkelse 21. august


