Hvad er bøjet regel i triatomiske molekyler?
"Elektronegative substituenter har en tendens til at øge S -karakteren af de hybrid orbitaler, der bruges af det centrale atom i en binding."
Sådan fungerer det:
1. Enlige par elektroner er mere lokaliserede omkring det centrale atom end bindingspar. De udøver en større frastødende kraft end bindingspar.
2. hybridisering og S -karakter: Hybridisering er blandingen af atomiske orbitaler for at skabe nye hybrid -orbitaler. Hybrid -orbitaler med en højere S -karakter er mere kompakte og lokaliserede, hvilket fører til en mindre bindingsvinkel.
3. Elektronegativitet: Elektronegative atomer trækker elektrondensitet mod sig selv, hvilket gør bindingen mere polær. Denne polarisering mindsker elektrondensiteten omkring det centrale atom, hvilket reducerer frastødningen mellem det ensomme par og bindingsparet.
i triatomiske molekyler:
- centralt atom uden ensomme par: Hvis det centrale atom ikke har nogen ensomme par, vil hybridiseringen være SP (lineær geometri) eller SP² (trigonal plane geometri), hvor S -karakteren af hybrid orbitaler er jævnt fordelt over bindingerne.
- centralt atom med et ensomt par: Det ensomme par skubber bindingsparene tættere sammen, hvilket resulterer i en bøjet molekylær geometri. S -karakteren i hybrid orbitaler vil være højere i det ensomme par orbital og lavere i binding af orbitaler. Dette gør bindingsvinklen mindre end den ideelle vinkel.
- centralt atom med to ensomme par: De to ensomme par vil udøve endnu større frastødelse, hvilket fører til en mindre bindingsvinkel og en mere bøjet form.
Eksempel:
Overvej molekylet af vand (H₂O). Oxygenatomet har to ensomme par og to bindingspar. De ensomme par har en højere S -karakter end bindingsparene, hvilket fører til en bøjet form med en bindingsvinkel på ca. 104,5 °.
Kortfattet: Den bøjede regel hjælper os med at forstå, hvordan tilstedeværelsen af ensomme par og elektronegative substituenter påvirker hybridiseringen og geometrien af molekyler. Det giver en ramme for at forudsige form og egenskaber af molekyler baseret på deres elektroniske struktur.
 Varme artikler
Varme artikler
-
 Mælkesyrebakterier kan forlænge fødevarers holdbarhedKredit:CC0 Public Domain Forskere ved National Food Institute, Tekniske Universitet Danmark, har genereret en mælkesyrebakterie, der effektivt udskiller et konserveringsmiddel af fødevarekvalitet,
Mælkesyrebakterier kan forlænge fødevarers holdbarhedKredit:CC0 Public Domain Forskere ved National Food Institute, Tekniske Universitet Danmark, har genereret en mælkesyrebakterie, der effektivt udskiller et konserveringsmiddel af fødevarekvalitet, -
 Forskere opdager neurotoksin i Lake WinnipegStephanie Bishop, en kandidatstuderende i kemi ved UBC Okanagan, har en prøve fra Lake Winnipeg. Kredit:UBC Okanagan En ny undersøgelse fra UBCs Okanagan-campus har fundet ud af, at BMAA - et toks
Forskere opdager neurotoksin i Lake WinnipegStephanie Bishop, en kandidatstuderende i kemi ved UBC Okanagan, har en prøve fra Lake Winnipeg. Kredit:UBC Okanagan En ny undersøgelse fra UBCs Okanagan-campus har fundet ud af, at BMAA - et toks -
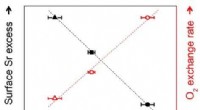 Brændselscellernes levetid maksimeres ved hjælp af en lille mængde metallerKorrelation mellem omfanget af gitterstamme i elektrode, strontiumsegregering, og elektrodereaktion. Kredit:KAIST Brændselsceller er en vigtig fremtidig energiteknologi, der fremstår som miljøvenl
Brændselscellernes levetid maksimeres ved hjælp af en lille mængde metallerKorrelation mellem omfanget af gitterstamme i elektrode, strontiumsegregering, og elektrodereaktion. Kredit:KAIST Brændselsceller er en vigtig fremtidig energiteknologi, der fremstår som miljøvenl -
 Enzymbiofabrikker til forbedring af navlestrengsblodtransplantationerForskerne viste, at deres gær- og silkeorm-afledte enzym langt bedre end kommercielle kilder til enzymet fremstillet i standard ekspressionssystemer. Kredit:KAUST; Heno Hwang En ny måde at produce
Enzymbiofabrikker til forbedring af navlestrengsblodtransplantationerForskerne viste, at deres gær- og silkeorm-afledte enzym langt bedre end kommercielle kilder til enzymet fremstillet i standard ekspressionssystemer. Kredit:KAUST; Heno Hwang En ny måde at produce
- Vil du have den korteste vej til et godt liv? Prøv kynisme
- Udviklingen af slim:Hvordan fik vi alt dette slim?
- Hvor mange valensskal af germanium?
- Harley-Davidsons elektriske Hog:0 til 60 mph på 3 sekunder
- Billede:Hubble ser nyfødte stjerner i armene på en spiralgalakse
- Hubbles lyse skinnende firbenstjerne


