Hvad er den elektroniske vand?
Elektrolyse af vand:Opdeling af H2O i dets elementer
Elektrolyse af vand er en kemisk proces, hvor elektricitet bruges til at nedbryde vand (H₂O) til dets bestanddele:brintgas (H₂) og iltgas (O₂) .
Her er en sammenbrud:
Hvad sker der:
* jævnstrøm: En jævnstrøm (DC) elektrisk strøm føres gennem vand, der indeholder en lille mængde elektrolyt (som salt eller syre) for at forbedre ledningsevnen.
* Elektroder: To elektroder, typisk lavet af inerte materialer som platin eller rustfrit stål, er nedsænket i vandet.
* Oxidation og reduktion: Ved den negative elektrode (katode) får vandmolekyler elektroner (reduktion) og producerer brintgas (H₂):
* 2H₂O + 2E⁻ → H₂ + 2OH⁻
* Oxidation og reduktion: Ved den positive elektrode (anode) mister vandmolekyler elektroner (oxidation) og producerer iltgas (O₂):
* 2H₂O → O₂ + 4H⁺ + 4E⁻
* samlet reaktion: Den samlede reaktion kombinerer de to halvreaktioner, hvilket resulterer i:
* 2H₂O → 2H₂ + O₂
Nøglepunkter:
* forhold: Mængden af produceret brintgas er altid dobbelt så stor mængden af iltgas.
* elektrolyt: Elektrolytten hjælper med at forbedre ledningsevnen i vand, hvilket giver den elektriske strøm mulighed for at flyde lettere.
* applikationer: Elektrolyse af vand har forskellige anvendelser, herunder:
* brintproduktion: Producerer brint som en ren energikilde.
* Oxygenproduktion: Til industrielle og medicinske formål.
* Vandoprensning: Fjernelse af urenheder og forurenende stoffer fra vand.
Vigtig note:
Elektrolyse kræver en betydelig mængde energi, hvilket gør den til en energikrævende proces. Derfor er det vigtigt at bruge vedvarende energikilder til at drive processen til bæredygtig brintproduktion.
Sammenfattende er elektrolyse af vand en proces med at nedbryde vand til brint- og iltgasser ved hjælp af elektricitet. Det har adskillige applikationer i forskellige brancher og er en nøgleteknologi til udvikling af en ren energi fremtid.
Sidste artikelHvilken væske bliver en gas ved 100 grader celsius?
Næste artikelHenviser atomstrukturerne til opbygning af forbindelser?
 Varme artikler
Varme artikler
-
 Mikrobølger mod koldstart-emissionerDen geometriske keramiske struktur af testkatalysatoren designet på computeren. Specialister hos Empa coated det med det katalytisk aktive lag og testede renseeffekten i en kunstig strøm af udstødning
Mikrobølger mod koldstart-emissionerDen geometriske keramiske struktur af testkatalysatoren designet på computeren. Specialister hos Empa coated det med det katalytisk aktive lag og testede renseeffekten i en kunstig strøm af udstødning -
 Ny teknik til bestemmelse af afstand i cellerIn-celleafstandsbestemmelse ved EPR afslører væsentlig strukturel information om biomakromolekyler under native betingelser. For første gang, den pulserede EPR -teknik RIDME (relaxation induced dipola
Ny teknik til bestemmelse af afstand i cellerIn-celleafstandsbestemmelse ved EPR afslører væsentlig strukturel information om biomakromolekyler under native betingelser. For første gang, den pulserede EPR -teknik RIDME (relaxation induced dipola -
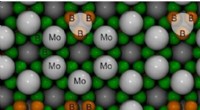 Forskere beregner krystalstruktur af superhårde molybdænboriderAtomarrangement i den højeste molybdænborid (MoB5-x) krystal Kredit:Dmitry V. Rybkovskiy, J. Phys. Chem. Lett. I deres søgen efter nye superhårde forbindelser, forskere har udført en forudsigelse
Forskere beregner krystalstruktur af superhårde molybdænboriderAtomarrangement i den højeste molybdænborid (MoB5-x) krystal Kredit:Dmitry V. Rybkovskiy, J. Phys. Chem. Lett. I deres søgen efter nye superhårde forbindelser, forskere har udført en forudsigelse -
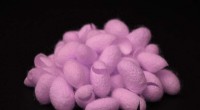 Langrødt fluorescerende silke kan dræbe skadelige bakterier som biomedicinsk og miljømæssigt mid…Når et grønt lys skinner på rød fluorescerende silke, en mekanisme til at dræbe patogener aktiveres. Kredit:Purdue University image/Jung Woo Leem Et silkehybridmateriale angriber bakterier, når de
Langrødt fluorescerende silke kan dræbe skadelige bakterier som biomedicinsk og miljømæssigt mid…Når et grønt lys skinner på rød fluorescerende silke, en mekanisme til at dræbe patogener aktiveres. Kredit:Purdue University image/Jung Woo Leem Et silkehybridmateriale angriber bakterier, når de
- Affald fra toppen af verden afleveret til genbrug i Nepal
- Hvilke mineraler findes i alluvial jord?
- CeCoIn5 afslører nye hemmeligheder om, hvordan superledning og magnetisme kan hænge sammen
- Mosaiske græslandskaber er de mest gavnlige med hensyn til økosystemtjenester, finder schweizisk u…
- Åben digital kortlægning til vurdering af kulstoflagring i tropiske tørveområder
- Australien har flere hjemmehørende fuglearter end næsten noget andet sted. Hvad førte til denne e…


