Hvad er forskellen mellem fast og væske?
faste stoffer:
* Fast form og volumen: Faststoffer har en bestemt form og volumen, hvilket betyder, at de ikke ændrer sig, medmindre der anvendes en ekstern kraft.
* Stærke intermolekylære kræfter: Partiklerne i et fast stof er tæt pakket sammen med stærke intermolekylære kræfter. Disse kræfter holder partiklerne i en fast, stiv struktur.
* Begrænset bevægelse: Partiklerne i et fast stof kan kun vibrere i deres faste positioner. De kan ikke bevæge sig frit.
væsker:
* fast volumen, men tager formen på dens beholder: Væsker har et bestemt volumen, men de tager formen på deres beholder.
* svagere intermolekylære kræfter: Partiklerne i en væske er tæt på hinanden, men de har svagere intermolekylære kræfter sammenlignet med faste stoffer. Dette gør det muligt for partiklerne at bevæge sig mere frit.
* mere bevægelse: Partikler i en væske kan bevæge sig rundt om hinanden og flyde.
her er en simpel analogi:
* Forestil dig en gruppe mennesker, der er tæt pakket i et rum, der holder hænder (solid). De kan kun bevæge sig lidt, og deres positioner er faste.
* Forestil dig nu de samme mennesker i et overfyldt rum med mindre håndholdning (væske). De kan bevæge sig rundt om hinanden, men de er stadig tæt på hinanden.
Her er en tabel, der opsummerer forskellene:
| Funktion | Solid | Væske |
| --- | --- | --- |
| Form | Fast | Tager formen på sin beholder |
| Bind | Fast | Fast |
| Intermolekylære kræfter | Stærk | Svag |
| Partikelbevægelse | Vibrerer i faste positioner | Flyt rundt og flow |
Kort sagt er faste stoffer mere stive og har en fast form på grund af stærke intermolekylære kræfter, mens væsker er mere flydende og tager formen på deres beholder på grund af svagere intermolekylære kræfter.
 Varme artikler
Varme artikler
-
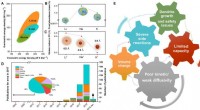 Forskere skitserer den nuværende tilstand af kalium-ion-batteriteknologiPIBs muligheder og udfordringer. (A) sammenligning af LIB, SIB, og PIB med hensyn til energitæthed. (B) overflod af lithium, natrium, og kaliummetal i jordskorpen (vægt%). (C) Stokes radius af Li+, Na
Forskere skitserer den nuværende tilstand af kalium-ion-batteriteknologiPIBs muligheder og udfordringer. (A) sammenligning af LIB, SIB, og PIB med hensyn til energitæthed. (B) overflod af lithium, natrium, og kaliummetal i jordskorpen (vægt%). (C) Stokes radius af Li+, Na -
 Mikrobielle cyborgs:Bakterier, der leverer strømBakterierne (grønne) er indlejret i en komposit fremstillet af carbon nanorør (grå) og silica nanopartikler (violet) sammenvævet med DNA (blå). (Grafik:Niemeyer Lab, KIT) Kredit:Grafik:Niemeyer Lab, K
Mikrobielle cyborgs:Bakterier, der leverer strømBakterierne (grønne) er indlejret i en komposit fremstillet af carbon nanorør (grå) og silica nanopartikler (violet) sammenvævet med DNA (blå). (Grafik:Niemeyer Lab, KIT) Kredit:Grafik:Niemeyer Lab, K -
 Visualisering af varmeflow i bambus kan hjælpe med at designe mere energieffektive og brandsikre by…Kredit:Pixabay Modificerede naturlige materialer vil være en væsentlig komponent i en bæredygtig fremtid, men først er der behov for en detaljeret forståelse af deres egenskaber. Måden varme strøm
Visualisering af varmeflow i bambus kan hjælpe med at designe mere energieffektive og brandsikre by…Kredit:Pixabay Modificerede naturlige materialer vil være en væsentlig komponent i en bæredygtig fremtid, men først er der behov for en detaljeret forståelse af deres egenskaber. Måden varme strøm -
 Kviksølvfjernelse gjort let i giftige miljøerKredit:Pixabay/CC0 Public Domain Kviksølvforurening er et globalt problem i vand, luft og jord i nærheden af guldminer, cement og noget metalproduktion og andre tunge industrier, der brænder foss
Kviksølvfjernelse gjort let i giftige miljøerKredit:Pixabay/CC0 Public Domain Kviksølvforurening er et globalt problem i vand, luft og jord i nærheden af guldminer, cement og noget metalproduktion og andre tunge industrier, der brænder foss
- Jet i Jupiters atmosfære viste sig at svinge i cirka fire-årige perioder
- Fingertip touch fingerpeg til menneskelige forfædre, der udnytter trætopmiljøer
- Klimaforberedte lande taber terræn, viser det seneste indeks
- De bedste måder at lave et æg på Drop
- Hvad blev rumfartøjet brugt i Apollo 1?
- En game changer:Metagenomisk clustering drevet af supercomputere


