Hvad sker der med atomerne, når et stof skifter tilstand fra flydende gas?
* Øget afstand: Atomerne i en væske er tæt sammen og bevæger sig frit rundt. I en gas er atomerne langt længere fra hinanden og bevæger sig tilfældigt med meget højere hastigheder.
* Øget kinetisk energi: Atomerne i en gas har betydeligt mere kinetisk energi (bevægelsesenergi) end dem i en væske. Dette skyldes, at de bevæger sig hurtigere og har overvundet de attraktive kræfter, der holder dem sammen i flydende tilstand.
* svækkede intermolekylære kræfter: De intermolekylære kræfter (attraktioner mellem molekyler), der holder væsken sammen, er meget svagere i en gas. Dette gør det muligt for atomerne at bevæge sig frit og uafhængigt.
Tænk på det på denne måde:
Forestil dig et overfyldt værelse fuld af mennesker (som en væske). De er tæt på hinanden og støder på hinanden. Derefter spreder alle sig pludselig ud og begynder at løbe rundt i rummet (som en gas). Folket er stadig de samme, men de har mere plads og bevæger sig hurtigere.
Her er nogle vigtige punkter at huske:
* atomerne i sig selv ændrer ikke: Atomerne i en væske og en gas er den samme type atomer. Kun deres arrangement og energiniveau ændres.
* Energi er påkrævet: For at skifte fra en væske til en gas skal energi føjes til stoffet for at overvinde de intermolekylære kræfter og øge atomernes kinetiske energi.
* Den modsatte proces er kondens: Når en gas skifter tilbage til en væske, mister atomerne energi, bremser ned og kommer tættere sammen.
Fortæl mig, hvis du gerne vil gå i dybden med nogen af disse punkter mere detaljeret!
Sidste artikelHvad viser den periodiske tabel os om atomer i forskellige elementer?
Næste artikelHvad var vigtigheden af voltaisk bunke?
 Varme artikler
Varme artikler
-
 CRISPRs vokseværkKredit:CC0 Public Domain I de seks år siden starten, CRISPR-genredigering har oplevet op- og nedture, fra svimlende begejstring over teknologiens potentiale til at helbrede genetiske sygdomme til
CRISPRs vokseværkKredit:CC0 Public Domain I de seks år siden starten, CRISPR-genredigering har oplevet op- og nedture, fra svimlende begejstring over teknologiens potentiale til at helbrede genetiske sygdomme til -
 Konstrueret gær kunne udvide biobrændstoffers rækkeviddeKredit:CC0 Public Domain At øge produktionen af biobrændstoffer som ethanol kan være et vigtigt skridt i retning af at reducere det globale forbrug af fossile brændstoffer. Imidlertid, ethanolpr
Konstrueret gær kunne udvide biobrændstoffers rækkeviddeKredit:CC0 Public Domain At øge produktionen af biobrændstoffer som ethanol kan være et vigtigt skridt i retning af at reducere det globale forbrug af fossile brændstoffer. Imidlertid, ethanolpr -
 En kold opblødning sænker risikoen for salmonellavækst på spirede fødevarerKorn, frø og nødder, der er lagt i blød i koldt vand. Kredit:Joy Waite-Cusic, Oregon State University Iblødsætning af spirede fødevarer i koldt vand, snarere end den mere almindelige praksis med i
En kold opblødning sænker risikoen for salmonellavækst på spirede fødevarerKorn, frø og nødder, der er lagt i blød i koldt vand. Kredit:Joy Waite-Cusic, Oregon State University Iblødsætning af spirede fødevarer i koldt vand, snarere end den mere almindelige praksis med i -
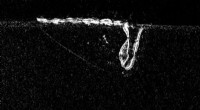 Sprængning af dine (små) bobler:ny forskning peger på vejen mod porefri 3D-printDette røntgenbillede taget ved APS viser en lasersmeltende aluminium under den additive fremstillingsproces. Til venstre for laseren kan du se små porer skabt under processen, som over tid kan skabe f
Sprængning af dine (små) bobler:ny forskning peger på vejen mod porefri 3D-printDette røntgenbillede taget ved APS viser en lasersmeltende aluminium under den additive fremstillingsproces. Til venstre for laseren kan du se små porer skabt under processen, som over tid kan skabe f
- Hvad bidrager mest til forurening?
- Når flyet flyver i en konstant højde, som to kræfter skal være afbalanceret?
- Hvad er menneskeskabt, der har ilt i sig?
- At fremstille proteiner indeholder alle celler også?
- Hvilket videnskabeligt gennembrud gjorde pladsflyvning mulig?
- Forskere finder ud af, at nøjagtig transskribering af DNA tilsidesætter DNA-reparation


