Hvorfor er elementer, der får eller mister 1 elektron de mest aktive metaller ikke -metaller?
Her er en sammenbrud:
* metaller Tendens til at tabe Elektroner for at opnå en stabil elektronkonfiguration.
* ikke -metaller har tendens til at vinde Elektroner for at opnå en stabil elektronkonfiguration.
elementer, der let får eller mister en elektron, er generelt mere reaktive, men dette gør dem ikke automatisk til det mest aktive.
Her er hvorfor:
* reaktivitet afhænger af flere faktorer: Den lette at vinde eller miste elektroner (ioniseringsenergi for metaller og elektronaffinitet for ikke -metaller) er kun en faktor, der bestemmer reaktivitet. Andre faktorer inkluderer:
* Størrelse på atomet: Mindre atomer har en tendens til at være mere reaktive.
* Elektronegativitet: Et atoms evne til at tiltrække elektroner.
* atomafgift: En højere atomafgift kan øge reaktiviteten.
* Gruppendenser: De mest reaktive metaller findes normalt i gruppe 1 (alkalimetaller) og gruppe 2 (alkaliske jordmetaller) af den periodiske tabel. De mister let henholdsvis en eller to elektroner. De mest reaktive ikke -metaller findes i gruppe 17 (halogener), som let får en elektron.
* Undtagelser: Mens elementer, der får eller mister en elektron, ofte er meget reaktive, er der undtagelser. For eksempel kan nogle elementer midt i den periodiske tabel miste eller få flere elektroner, hvilket fører til forskellige niveauer af reaktivitet.
Konklusion:
Mens antallet af opnåede eller mistede elektroner kan være en faktor i reaktivitet, er det ikke den eneste determinant. De mest aktive metaller og ikke -metaller er dem, der udviser en stærk tendens til at miste eller få elektroner henholdsvis på grund af en kombination af faktorer som atomstørrelse, elektronegativitet og atomafgift.
Sidste artikelHvad er inerte metaller?
Næste artikelHvordan vokser du vismuth -krystaller?
 Varme artikler
Varme artikler
-
 Historiske film forfalder muligvis meget hurtigere, end vi troede, takket være eddikesyndromCellulose triacetat 16 mm film med alvorligt eddikesyndrom, dateret 1968. Kredit:Ida Ahmad, Forfatter angivet En betydelig del af verdens historie står over for en eksistentiel trussel. amerikansk
Historiske film forfalder muligvis meget hurtigere, end vi troede, takket være eddikesyndromCellulose triacetat 16 mm film med alvorligt eddikesyndrom, dateret 1968. Kredit:Ida Ahmad, Forfatter angivet En betydelig del af verdens historie står over for en eksistentiel trussel. amerikansk -
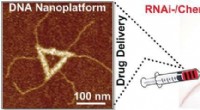 DNA origami fuld af potente kræftfremkaldende midlerKredit:Wiley En af de mest succesfulde teknikker til bekæmpelse af multilægemiddelresistens i kræftceller er nedregulering af de gener, der er ansvarlige for lægemiddelresistens. Kinesiske forsker
DNA origami fuld af potente kræftfremkaldende midlerKredit:Wiley En af de mest succesfulde teknikker til bekæmpelse af multilægemiddelresistens i kræftceller er nedregulering af de gener, der er ansvarlige for lægemiddelresistens. Kinesiske forsker -
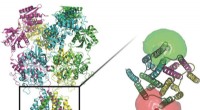 Forskere bruger lysfølsomme molekyler til at spore proteiner, der er kritiske for cellesignaleringForskere ved Rice University og UTHealth sporede konformationerne af proteiner, der står vagt ved transmembrane kanaler i nervecellernes vægge. I bunden af proteinerne på dette billede er fluorofore
Forskere bruger lysfølsomme molekyler til at spore proteiner, der er kritiske for cellesignaleringForskere ved Rice University og UTHealth sporede konformationerne af proteiner, der står vagt ved transmembrane kanaler i nervecellernes vægge. I bunden af proteinerne på dette billede er fluorofore -
 Forskere opdager en ny måde at splitte og summe fotoner med siliciumSilicium -nanokrystaller dannes af en silangas i en plasmaprocess. Kredit:Lorenzo Mangolini/UC Riverside Et team af forskere ved The University of Texas i Austin og University of California, River
Forskere opdager en ny måde at splitte og summe fotoner med siliciumSilicium -nanokrystaller dannes af en silangas i en plasmaprocess. Kredit:Lorenzo Mangolini/UC Riverside Et team af forskere ved The University of Texas i Austin og University of California, River
- Bezos tilbyder NASA en rabat på 2 milliarder dollars til Blue Origin Moon lander
- Hvad hedder mineralrig silt, der deponerede på banker?
- Afkobling fra Kina på ren teknologi indebærer langt flere risici end belønning, viser undersøgel…
- Kan du se de samme stjerner i USA og Irak?
- Hvorfor kan luftvand og isbrud klipper i små fragmenter?
- Multiframe-billeddannelse af mikron- og nanoskala bobledynamik


