Hvilke observationer kan foretages, når fortyndet salpetersyre tilsættes til blycarbonat?
Observationer:
1. fizzing/brusning: Den mest øjeblikkelige observation er den hurtige dannelse af bobler, hvilket indikerer frigivelse af en gas. Dette er kuldioxid (CO2), et produkt af reaktionen.
2. opløsning: Når reaktionen fortsætter, opløses det hvide faste blycarbonat (PBCO3) gradvist. Dette skyldes, at salpetersyren reagerer med blycarbonatet og danner opløseligt blynitrat (PB (NO3) 2).
3. farveændring: Oprindeligt vil løsningen være farveløs. Efterhånden som reaktionen skrider frem, kan en let gul farvetone forekomme på grund af dannelsen af blyioner i opløsning.
4. Temperaturændring: Reaktionen er lidt eksoterm, hvilket betyder, at den frigiver en lille mængde varme. Du vil muligvis bemærke en let opvarmning af løsningen.
Kemisk ligning:
Reaktionen kan repræsenteres ved følgende afbalancerede kemiske ligning:
PBCO3 (S) + 2 HNO3 (AQ) → PB (NO3) 2 (AQ) + H2O (L) + CO2 (G)
Forklaring:
* salpetersyre (HNO3) er en stærk syre, hvilket betyder, at den let donerer hydrogenioner (H+).
* blycarbonat (PBCO3) er en solid, uopløselig forbindelse.
* blynitrat (PB (NO3) 2) er en opløselig ionisk forbindelse, så den opløses i opløsningen.
* kuldioxid (CO2) er en farveløs gas, der slipper ud af opløsningen og forårsager fizzing.
* vand (H2O) produceres også i reaktionen.
Vigtig note:
* Koncentrationen af salpetersyren vil påvirke reaktionshastigheden. Mere koncentreret syre vil føre til en hurtigere reaktion og mere kraftig fizzing.
* Ledningsioner er giftige, så håndter dette eksperiment med forsigtighed og bortskaffes opløsningen korrekt.
 Varme artikler
Varme artikler
-
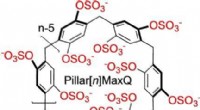 Molekylære beholdere til sekvestrering af neurotransmitterlægemidler i vandPillar[n]MaxQ:En ny værtsfamilie med høj affinitet til sekvestration i vand. Kredit:Angewandte Chemie International Edition Molekylære beholdere, der fjerner stoffer, toksiner, eller ildelugtende
Molekylære beholdere til sekvestrering af neurotransmitterlægemidler i vandPillar[n]MaxQ:En ny værtsfamilie med høj affinitet til sekvestration i vand. Kredit:Angewandte Chemie International Edition Molekylære beholdere, der fjerner stoffer, toksiner, eller ildelugtende -
 Forskere udvikler mikrobobler til at ødelægge farlige biofilmProfessor i kemisk og biomolekylær ingeniørvidenskab Simon Rogers, venstre, postdoktorale forskere Jun Pong Park og Yongbeom Seo og professor i kemisk og biomolekylær teknik Hyunjoon Kong ledede et in
Forskere udvikler mikrobobler til at ødelægge farlige biofilmProfessor i kemisk og biomolekylær ingeniørvidenskab Simon Rogers, venstre, postdoktorale forskere Jun Pong Park og Yongbeom Seo og professor i kemisk og biomolekylær teknik Hyunjoon Kong ledede et in -
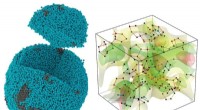 3D-billedundersøgelse afslører, hvordan atomer er pakket i amorfe materialerEksperimentelt 3D-atombillede af en lille, ikke-krystallinsk palladiumpartikel (venstre), hvor den 10-sidede femkantede bipyramide (til højre) er det mest udbredte motiv for, hvordan atomer pakker sam
3D-billedundersøgelse afslører, hvordan atomer er pakket i amorfe materialerEksperimentelt 3D-atombillede af en lille, ikke-krystallinsk palladiumpartikel (venstre), hvor den 10-sidede femkantede bipyramide (til højre) er det mest udbredte motiv for, hvordan atomer pakker sam -
 Ændringer i farve indikerer materialedeformationerEn revne, der ikke er synlig udefra, dannes og formerer sig inde i materialet. Ved det første tegn på skade, det begynder at fluorescere. Kredit: ACS Appl. Mater. Grænseflader ETH Zürich -forsker
Ændringer i farve indikerer materialedeformationerEn revne, der ikke er synlig udefra, dannes og formerer sig inde i materialet. Ved det første tegn på skade, det begynder at fluorescere. Kredit: ACS Appl. Mater. Grænseflader ETH Zürich -forsker
- Undersøgelse viser, hvordan eksterne økologiske samfund kan påvirke samudviklingen af værter o…
- Hvilket udtryk beskriver en proces, der kun finder sted i flercellede organismer, og hvor celler har…
- Hvordan får en protist mad?
- Hvad bekræftede Galileo, da han opdagede faserne af Venus og solflekker?
- Røntgenforskere skaber små, super-tynde plader med rindende vand, der skinner som sæbebobler
- Ny biosyntetisk vej unik for patogene mikroorganismer


