Hvorfor flyder faste stoffer ikke?
* Stærke intermolekylære kræfter: Faststoffer har stærke intermolekylære kræfter (tiltrækningskræfter mellem molekyler), der holder partiklerne tæt sammen. Disse kræfter er stærke nok til at overvinde molekylernes kinetiske energi og holde dem i en fast position.
* lav kinetisk energi: Partiklerne i faste stoffer har meget lav kinetisk energi. Dette betyder, at de vibrerer på plads, men de har ikke nok energi til at bryde fri fra deres faste positioner og bevæge sig rundt.
* bestemt form og volumen: Dette faste arrangement af partikler giver faste stoffer deres konkrete form og volumen. De modstår ændringer i deres form og volumen, fordi partiklerne er låst på plads.
I modsætning til faste stoffer, væsker og gasser har:
* svagere intermolekylære kræfter: Tillader partikler at bevæge sig mere frit.
* Højere kinetisk energi: At give partikler mere energi til at bryde fri fra deres oprindelige positioner.
Tænk på det på denne måde: Forestil dig en mængde mennesker, der står tæt pakket sammen. Dette er som partiklerne i et fast stof. Forestil dig nu, at folket begynder at bevæge sig rundt og støder på hinanden. Dette er som partiklerne i en væske. Endelig forestil dig, at folket alle løber rundt og støder konstant på hinanden. Dette er som partiklerne i en gas.
Sidste artikelHvilke metaller pletter mindst?
Næste artikelDet er klart, at definitionen af elektrolyse?
 Varme artikler
Varme artikler
-
 Til lithiummetal, mindre er stærkereMellem diffusionskryb og dislokationsglidning, lithiummetal lindrer atomisk stress gennem brud, en zone kaldet faredefektzonen. Kredit:Michigan Technological University Dannelsen af lithiumdendr
Til lithiummetal, mindre er stærkereMellem diffusionskryb og dislokationsglidning, lithiummetal lindrer atomisk stress gennem brud, en zone kaldet faredefektzonen. Kredit:Michigan Technological University Dannelsen af lithiumdendr -
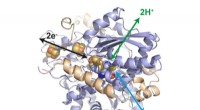 Enzymsystem til brintindustrienStruktur af hydrogenasen fra Desulfovibrio desulfuricans. I sit aktive center, en jern-svovl-klynge katalyserer oxidation af hydrogen til protoner samt reduktion af protoner til hydrogen. Yderligere j
Enzymsystem til brintindustrienStruktur af hydrogenasen fra Desulfovibrio desulfuricans. I sit aktive center, en jern-svovl-klynge katalyserer oxidation af hydrogen til protoner samt reduktion af protoner til hydrogen. Yderligere j -
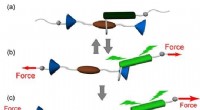 Nysgerrige sammenlåste molekyler viser dobbelt responsFigur 1. Skematisk illustration af driften af en rotaxan-baseret mekanophor, viser (a) kraftfri tilstand, (b) reversibel, og (c) irreversible svar. Forskere udforskede en mærkelig sammenkoblet molek
Nysgerrige sammenlåste molekyler viser dobbelt responsFigur 1. Skematisk illustration af driften af en rotaxan-baseret mekanophor, viser (a) kraftfri tilstand, (b) reversibel, og (c) irreversible svar. Forskere udforskede en mærkelig sammenkoblet molek -
 Forskere opdager, at trækul fanger ammoniakforureningRachel Hestrin (til højre) på beamlines ved canadian light Source sammen med Cornell-forsker Angela Possinger. Kredit:Canadian Light Source Cornell University-forskerne Rachel Hestrin og Johannes
Forskere opdager, at trækul fanger ammoniakforureningRachel Hestrin (til højre) på beamlines ved canadian light Source sammen med Cornell-forsker Angela Possinger. Kredit:Canadian Light Source Cornell University-forskerne Rachel Hestrin og Johannes
- Hvilket udtryk beskriver et stof, som Rhat sænker den mængde energi, der er nødvendig for at star…
- Elektriske ledningsbugs Hvordan fik de deres navn?
- Hvorfor drejer Pulsar Stars?
- Er ændringen i form af sten på grund af stress?
- Hvordan blev Hercules -konstellationen opdaget?
- Hvordan vender du opløst sukker?


