Hvad er det regelmæssige arrangement af molekyler til diamanter og rubiner?
diamanter
* krystalstruktur: Diamond har en ansigtscentreret kubisk (FCC) gitterstruktur. Dette betyder:
* Carbonatomer er arrangeret i et tredimensionelt, gentagende mønster.
* Hvert carbonatom er bundet til fire andre carbonatomer i en tetrahedral form (som en pyramide).
* Denne stærke, tetrahedrale binding giver diamant sin utrolige hårdhed.
rubiner
* krystalstruktur: Rubiner er en række corundum, der har en hexagonal tætpakket (HCP) struktur.
* Denne struktur er mindre tæt pakket end FCC -strukturen af diamant.
* Aluminiums- og iltatomer danner et hexagonalt gitter.
* Kromioner (CR³⁺) Udskift nogle af aluminiumionerne, hvilket giver Ruby sin røde farve.
Nøgleforskelle i struktur:
* binding: Diamonds stærke kovalente bindinger mellem carbonatomer gør det til det sværeste naturligt forekommende mineral. Rubys ioniske bindinger er svagere.
* symmetri: FCC -strukturen af diamant har højere symmetri end HCP -strukturen af Ruby.
* Pakning: Diamonds FCC -struktur er mere tæt pakket end Rubys HCP -struktur.
I et nøddeskal: Forskellen i det regelmæssige arrangement af atomer i diamant og rubin er det, der giver dem deres forskellige egenskaber. Denne forskel i struktur er også grunden til, at Diamond er meget sværere end Ruby.
Sidste artikelHvad er egenskaberne ved en enzymatisk reaktion?
Næste artikelHvordan bevæger molekyler sig inden for en fast væske og gas?
 Varme artikler
Varme artikler
-
 Bioluminescerende orm viste sig at have jern supermagterPergamentrørorm fanget i marken. Kredit:Dr. Evelien De Meulenaere, Scripps Institution of Oceanography ved UC San Diego. Forskere ved Scripps Institution of Oceanography ved University of Californ
Bioluminescerende orm viste sig at have jern supermagterPergamentrørorm fanget i marken. Kredit:Dr. Evelien De Meulenaere, Scripps Institution of Oceanography ved UC San Diego. Forskere ved Scripps Institution of Oceanography ved University of Californ -
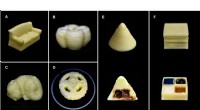 Forskere udvikler en enkel metode til 3-D-print af mælkeprodukterA - D:3D-printede mælkestrukturer af sofa, fæstning, hjul, og kløverblad, henholdsvis. E:3D-printet kegle indeholdende flydende chokoladesirup som internt fyld.F:3D-printet terning med fire rum indeho
Forskere udvikler en enkel metode til 3-D-print af mælkeprodukterA - D:3D-printede mælkestrukturer af sofa, fæstning, hjul, og kløverblad, henholdsvis. E:3D-printet kegle indeholdende flydende chokoladesirup som internt fyld.F:3D-printet terning med fire rum indeho -
 Ny leveringsmetode tillader langsom frigivelse af en bredere vifte af peptidlægemidler i kroppenScanning elektronmikrografer billeder af PLGA mikrosfærer. Repræsentative mikrofotografier af (a) blanke PLGA-mikrosfærer og (b) de tomme mikrosfærer fjernbelastet med octreotid (n = 2 uafhængige eksp
Ny leveringsmetode tillader langsom frigivelse af en bredere vifte af peptidlægemidler i kroppenScanning elektronmikrografer billeder af PLGA mikrosfærer. Repræsentative mikrofotografier af (a) blanke PLGA-mikrosfærer og (b) de tomme mikrosfærer fjernbelastet med octreotid (n = 2 uafhængige eksp -
 Affaldsplast, der omdannes til filtreringsmembranerBruno Pulido tester effektiviteten af holdets syntetiske membran. Kredit:KAUST I en verden, der synes at drukne i plastflasker, genanvendelse af dette affald til nyttige materialer ville bidrage
Affaldsplast, der omdannes til filtreringsmembranerBruno Pulido tester effektiviteten af holdets syntetiske membran. Kredit:KAUST I en verden, der synes at drukne i plastflasker, genanvendelse af dette affald til nyttige materialer ville bidrage
- Hvad er ændringerne i ægmassen i termosmose?
- Kinas Huawei afslører chip til det globale big data-marked
- Hvad er nogle eksempler på gammabølger?
- Robotværktøjsoperationer bringer tankning i rummet tættere på virkeligheden
- Hvad er de videnskabelige navne for to levende organismer?
- Differentier de tre metoder til varmeoverførsel?


