Er væsker altid mindre tætte end faste stoffer?
Her er hvorfor:
* densitet er masse pr. Enhedsvolumen.
* arrangementet af molekyler spiller en afgørende rolle i densitet. I faste stoffer er molekyler tæt pakket og arrangeret i et regelmæssigt, gentagende mønster. I væsker er de mindre tæt pakket og kan bevæge sig mere frit.
* Typen af molekyle betyder også noget. Nogle molekyler har stærkere intermolekylære kræfter end andre, hvilket fører til strammere pakning, selv i flydende form.
Eksempler på væsker, der er tættere end faste stoffer:
* Vand: Is (fast vand) er mindre tæt end flydende vand. Dette er grunden til, at is flyder.
* Merkur: Kviksølv er en væske ved stuetemperatur og er tættere end dens faste form.
Kortfattet: Selvom det er en almindelig misforståelse, afhænger densiteten af væsker sammenlignet med faste stoffer af det specifikke stof.
Sidste artikelHvad er de kemiske egenskaber ved sølv?
Næste artikelKontrast dannelse og brud på kemiske bindinger i termer energiændringer?
 Varme artikler
Varme artikler
-
 Bioinspirerede materialer—Graphen-aktiverede nikkelkompositterNi/grafen pulvere efter forskydningsblanding og frysetørring. (A) SEM billede af Ni/grafen pulvere, viser ingen mærkbar aggregering af grafenark. (B) TEM billede af overfladen af et Ni/grafen pulver
Bioinspirerede materialer—Graphen-aktiverede nikkelkompositterNi/grafen pulvere efter forskydningsblanding og frysetørring. (A) SEM billede af Ni/grafen pulvere, viser ingen mærkbar aggregering af grafenark. (B) TEM billede af overfladen af et Ni/grafen pulver -
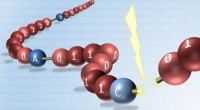 Verdens første til at læse digitalt kodede syntetiske molekylerVed at indsætte skrøbelige bindinger mellem hver molekylær byte, digitale polymerer kan let aflæses gennem massespektrometri. Kredit:Jean-François Lutz, Institut Charles Sadron (CNRS) Ved hjælp af
Verdens første til at læse digitalt kodede syntetiske molekylerVed at indsætte skrøbelige bindinger mellem hver molekylær byte, digitale polymerer kan let aflæses gennem massespektrometri. Kredit:Jean-François Lutz, Institut Charles Sadron (CNRS) Ved hjælp af -
 Bioinspirerede materialer-lån fra naturens legebogEt skibsskelet af havsvamp, der viser den komplekse karakter af dets struktur, som giver fantastisk styrke. Kredit:Michael Monn, Kesari Lab, Brown University Naturen giver utallige eksempler på un
Bioinspirerede materialer-lån fra naturens legebogEt skibsskelet af havsvamp, der viser den komplekse karakter af dets struktur, som giver fantastisk styrke. Kredit:Michael Monn, Kesari Lab, Brown University Naturen giver utallige eksempler på un -
 Organiske solceller, der holder 10 år i rummetKredit:Skoltech 6, 000 Gy, vækker håb om deres stabile drift i kredsløb nær jorden over 10 år eller endnu længere. Resultaterne af undersøgelsen blev offentliggjort i ACS anvendte materialer og g
Organiske solceller, der holder 10 år i rummetKredit:Skoltech 6, 000 Gy, vækker håb om deres stabile drift i kredsløb nær jorden over 10 år eller endnu længere. Resultaterne af undersøgelsen blev offentliggjort i ACS anvendte materialer og g
- Forskere sporer den kinesiske rumstation, når den falder
- Rocky kyster i Pacific Northwest viser lav modstandsdygtighed over for ændringer i klimaet
- Er det at polere en fysisk ændring af metal?
- Hvorfor kan en stjerne være lysere end anden stjerne?
- I en eksoterm reaktion er forskellen mellem kemisk energi hos reaktanter og produkter lig med?
- Luftprøver fra det arktiske område viser, hvor hurtigt Jorden opvarmes


