Hvad er de kemiske egenskaber ved sølv?
Kemiske egenskaber ved sølv:
Sølv er et overgangsmetal med en række interessante kemiske egenskaber:
1. Reaktivitet:
* ædle metal: Sølv er et ædle metal, hvilket betyder, at det er relativt ureaktivt sammenlignet med andre metaller som jern eller kobber. Det modstår korrosion og oxidation i atmosfæren.
* reaktion med oxidationsmidler: Mens de er resistente over for mest almindelige oxidatorer, reagerer sølv med stærke oxidationsmidler som salpetersyre og koncentreret svovlsyre.
* reaktion med svovl: Sølv reagerer med svovl- og svovlforbindelser og danner sølvsulfid (AG₂S), som er sort og ansvarlig for plettering af sølv.
2. Oxidation siger:
* fælles oxidationstilstand: Den mest almindelige oxidationstilstand for sølv er +1, der danner forbindelser som sølvchlorid (AgCl) og sølvnitrat (Agno₃).
* mindre almindelig oxidationstilstand: Sølv kan også eksistere i +2 og +3 oxidationstilstande, men disse er mindre almindelige.
3. Dannelse af komplekse ioner:
* sølvhalogenider: Sølvformer uopløselige halogenider (chlorider, bromider og iodider), som er vigtige i fotografiske processer.
* Koordinationskomplekser: Sølvioner kan danne komplekse ioner med ligander som ammoniak (NH₃), cyanid (CN⁻) og thiosulfat (S₂O₃²⁻). Disse komplekser er ofte opløselige og har forskellige egenskaber end den enkle sølvion.
4. Katalytiske egenskaber:
* Sølv har katalytiske egenskaber i forskellige kemiske reaktioner, såsom oxidationsreaktioner og produktionen af ethylenoxid.
5. Elektrisk og termisk ledningsevne:
* Fremragende leder: Sølv er en fremragende leder af elektricitet og varme. Denne egenskab gør den værdifuld i elektriske og elektroniske applikationer.
6. Antimikrobielle egenskaber:
* oligodynamisk effekt: Sølvioner udviser antimikrobielle egenskaber, kendt som den oligodynamiske virkning, på grund af deres evne til at forstyrre de metaboliske processer for mikroorganismer. Denne egenskab bruges i medicinske anvendelser og til vandrensning.
7. Andre egenskaber:
* duktil og formbar: Sølv er et duktilt og formbart metal, der gør det let at formes til forskellige former som ledninger og folier.
* Høj refleksionsevne: Sølv er meget reflekterende, især i det synlige spektrum, hvilket fører til dets anvendelse i spejle og smykker.
Dette er blot nogle af de vigtigste kemiske egenskaber ved sølv. Dens unikke egenskaber gør det til et værdifuldt metal med forskellige applikationer i forskellige brancher.
Sidste artikelHvad betyder kogende og smeltepunkt for gasser?
Næste artikelEr væsker altid mindre tætte end faste stoffer?
 Varme artikler
Varme artikler
-
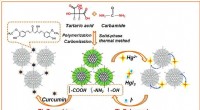 Hvordan nitrogen-doterede fluorescerende kulstofprikker hjælper kampen mod sygdomSkematisk diagram af forberedelses- og responsmekanismen for NCDer. Kredit:Wei Chen Evnen til pålideligt og præcist at detektere niveauer af iodidion og curcumin er afgørende inden for fødevare- o
Hvordan nitrogen-doterede fluorescerende kulstofprikker hjælper kampen mod sygdomSkematisk diagram af forberedelses- og responsmekanismen for NCDer. Kredit:Wei Chen Evnen til pålideligt og præcist at detektere niveauer af iodidion og curcumin er afgørende inden for fødevare- o -
 Protocellgæster flygter fra redenKonfokal fluorescensmikroskopibillede, der viser et tværsnit af en vært-gæst nestet protocelle bestående af et fanget gæstproteinosom (grønt), der er fanget inde i en vært-coacervat mikrodråbe (rød).
Protocellgæster flygter fra redenKonfokal fluorescensmikroskopibillede, der viser et tværsnit af en vært-gæst nestet protocelle bestående af et fanget gæstproteinosom (grønt), der er fanget inde i en vært-coacervat mikrodråbe (rød). -
 Forskere foreslår, at man anvender metanoverflader af guld til at bestemme stoffets molekylære sam…Guldpartikler Kredit:Dmitry Bayer En ny metode vil gøre det muligt at skabe kompakte enheder, der nøjagtigt bestemmer den molekylære sammensætning af en væske eller gas, og hjælpe med at identific
Forskere foreslår, at man anvender metanoverflader af guld til at bestemme stoffets molekylære sam…Guldpartikler Kredit:Dmitry Bayer En ny metode vil gøre det muligt at skabe kompakte enheder, der nøjagtigt bestemmer den molekylære sammensætning af en væske eller gas, og hjælpe med at identific -
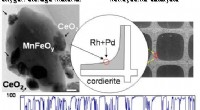 Ny katalysatorkomposit reducerer brugen af sjældne jordarterEn nyudviklet katalysator fra Japan, CeO2/MnFeOy, har både hurtig frigivelse og store opbevaringsmuligheder for ilt. Dens høje ydeevne i konverteringshastigheden af NOx, CO, og total kulbrinte til m
Ny katalysatorkomposit reducerer brugen af sjældne jordarterEn nyudviklet katalysator fra Japan, CeO2/MnFeOy, har både hurtig frigivelse og store opbevaringsmuligheder for ilt. Dens høje ydeevne i konverteringshastigheden af NOx, CO, og total kulbrinte til m
- Er en hypertonisk opløsning en med lav opløst koncentration?
- Et organisk alternativ til oxider? Organisk ferroelektrisk molekyle viser løfte for hukommelseschip…
- En præbiotisk vej til DNA
- Ny undersøgelse modsiger antagelser om konstante grundstofforhold i havene
- Undersøgelse ser på sårbarheden i San Francisco -skælvet
- Hvorfor er SiO2 mere opløselig i havvand vs frisk vand?


