Hvad betyder kogende og smeltepunkt for gasser?
* gasser findes over deres kogepunkt. Per definition er en gas allerede i sin gasformige tilstand ved normale temperaturer og tryk.
* smeltepunkt henviser til overgangen fra fast til væske. Gasser springer over den faste fase, så de har ikke et traditionelt smeltepunkt.
Vi kan dog stadig diskutere begrebet "kondensation" og "sublimering", når det kommer til gasser:
* kondens: Dette er processen, hvor en gas skifter til en væske. Temperaturen, hvorpå dette sker, kaldes kondensationspunktet . Dette er i det væsentlige det samme som kogepunktet, men omvendt.
* sublimering: Dette er processen, hvor en solid ændrer sig direkte til en gas, der springer over den flydende fase. Temperaturen, hvorpå dette sker, kaldes sublimeringspunktet .
Tænk på det på denne måde:
* kogepunkt: Temperaturen, hvormed en væske bliver til en gas.
* Kondensationspunkt: Temperaturen, hvormed en gas bliver til en væske (det samme som kogepunktet).
* smeltepunkt: Temperaturen, hvormed en fast drejer til en væske.
* sublimeringspunkt: Temperaturen, hvormed en fast drejer til en gas.
Eksempler:
* Vand: Vandets kogepunkt er 100 ° C (212 ° F). Dette er også dens kondensationspunkt.
* kuldioxid (CO2): CO2 er en gas ved stuetemperatur. Det har imidlertid et sublimeringspunkt på -78,5 ° C (-109,3 ° F). Dette betyder, at fast CO2 (tøris) direkte vil blive til en gas ved denne temperatur.
I det væsentlige, mens gasser ikke har et "kogepunkt" eller "smeltepunkt" i klassisk forstand, har de specifikke temperaturer, hvor de ændrer tilstande gennem kondens eller sublimering.
 Varme artikler
Varme artikler
-
 Effektiv kædeoverførsel til 3D-print af robuste fotopolymererKredit:Wiley Et stadigt voksende antal belægninger, inklusive lakker og trykfarver, samt tandfyldninger, hærdes med lys. Endnu, homogen, skræddersyet, polymernetværk kan ikke fremstilles, og mater
Effektiv kædeoverførsel til 3D-print af robuste fotopolymererKredit:Wiley Et stadigt voksende antal belægninger, inklusive lakker og trykfarver, samt tandfyldninger, hærdes med lys. Endnu, homogen, skræddersyet, polymernetværk kan ikke fremstilles, og mater -
 Chemputer lover app-styret revolution for lægemiddelproduktionEt billede af en kemputerobot. Kredit:Cronin Group, Kemiskolen, Glasgow En radikal ny metode til fremstilling af lægemiddelmolekyler, som bruger blueprints, der kan downloades, til let og pålideli
Chemputer lover app-styret revolution for lægemiddelproduktionEt billede af en kemputerobot. Kredit:Cronin Group, Kemiskolen, Glasgow En radikal ny metode til fremstilling af lægemiddelmolekyler, som bruger blueprints, der kan downloades, til let og pålideli -
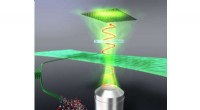 Fra nata de coco til computerskærme:Cellulose får en chance for at skinneKontrol af optisk retardering af den justerede cellulosefilm. Kredit:Osaka University Et hold ved Institute of Scientific and Industrial Research ved Osaka University har bestemt de optiske parame
Fra nata de coco til computerskærme:Cellulose får en chance for at skinneKontrol af optisk retardering af den justerede cellulosefilm. Kredit:Osaka University Et hold ved Institute of Scientific and Industrial Research ved Osaka University har bestemt de optiske parame -
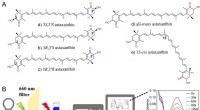 Forskelle fundet i antioxidantaktiviteter af astaxanthinisomerer mod singlet oxygen(A) Strukturer af stereoisomerer af astaxanthin. (B) Måling af singlet-iltslukningskapaciteten af antioxidanter. Kredit:Zheng Xinxin For nylig foreslog forskere ledet af prof. Huang Qing fra Inst
Forskelle fundet i antioxidantaktiviteter af astaxanthinisomerer mod singlet oxygen(A) Strukturer af stereoisomerer af astaxanthin. (B) Måling af singlet-iltslukningskapaciteten af antioxidanter. Kredit:Zheng Xinxin For nylig foreslog forskere ledet af prof. Huang Qing fra Inst
- Forskellige måder at smelte iskubene
- Hvad er belastningen af et lommelygte -kredsløb?
- Hvorfor bemærkede Darwin for sig selv aldrig ordet højere eller lavere, når man henviser til udvi…
- Ny enhed til at beskytte samfund i Colombia mod usikkert vand
- Er evolution og overlevelse af den bedste samme ting?
- Er stjerner varmere end solen?


