Hvad er pH -området for det resulterende produkt fra kuldioxid og kalkvand?
Her er hvorfor:
* Limewater er grundlæggende: Limewater er en opløsning af calciumhydroxid, en stærk base, hvilket gør det meget alkalisk med en pH -værdi større end 7.
* CO2 er sur: Kuldioxid opløses i vand til dannelse af kulsyre (H2CO3), en svag syre.
* neutralisering: Når CO2 er boblet gennem kalkvand, reagerer den sure kulsyre med det basale calciumhydroxid og neutraliserer opløsningen.
* Dannelse af calciumcarbonat: Denne neutraliseringsreaktion producerer calciumcarbonat (CACO3), som er uopløselig i vand og danner et hvidt bundfald.
* pH -ændring: Opløsningens pH -værdi falder, når carboninsyren neutraliserer calciumhydroxidet og bevæger det tættere på en neutral pH på 7.
Derfor har det resulterende produkt (calciumcarbonat) ikke et pH -område. Imidlertid falder opløsningens pH, når reaktionen fortsætter, og bevæger sig fra det meget alkaliske område af kalkvand mod en mere neutral ph.
Vigtig note: Det nøjagtige pH -område af den resulterende opløsning afhænger af den indledende koncentration af kalkvand og mængden af CO2 tilsat.
Sidste artikelHvad er ikke -eksempler på solid?
Næste artikelHvilket element er en ikke -metal og grøn gas?
 Varme artikler
Varme artikler
-
 Malkemolekyler fra mikroberEt hold af KAUST-forskere har udtænkt en metode til at udvinde nyttige kemikalier fra mikroalger. Systemet er baseret på en række membraner, hvoraf den ene er bygget af hule mikrofibre, der adskiller
Malkemolekyler fra mikroberEt hold af KAUST-forskere har udtænkt en metode til at udvinde nyttige kemikalier fra mikroalger. Systemet er baseret på en række membraner, hvoraf den ene er bygget af hule mikrofibre, der adskiller -
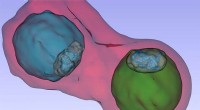 Malariapatogen under røntgenmikroskopetDetaljer såsom parasitternes vakuol (farvet i blåt og grønt) inde i en inficeret blodcelle. Kredit:S. Kapishnikov Malaria er en af de mest truende infektionssygdomme i verden. Et internationalt
Malariapatogen under røntgenmikroskopetDetaljer såsom parasitternes vakuol (farvet i blåt og grønt) inde i en inficeret blodcelle. Kredit:S. Kapishnikov Malaria er en af de mest truende infektionssygdomme i verden. Et internationalt -
 At se atomer bevæge sig i hybride perovskitkrystaller afslører spor til forbedring af solcellerDet indvendige bagsidebillede af den 20. november, 2017 udgave af Avancerede materialer illustrerer, hvordan ionmigrering i en hybrid perovskitkrystal påvirker solcellernes ydeevne i forskellige omr
At se atomer bevæge sig i hybride perovskitkrystaller afslører spor til forbedring af solcellerDet indvendige bagsidebillede af den 20. november, 2017 udgave af Avancerede materialer illustrerer, hvordan ionmigrering i en hybrid perovskitkrystal påvirker solcellernes ydeevne i forskellige omr -
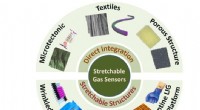 Forskere udvikler sensorer, der registrerer menneskelige biomarkører og giftig gasEt forskningshold fra Penn State, ledet af Huanyu Larry Cheng, Dorothy Quiggle Karriereudviklingsprofessor i Penn State Department of Engineering Science and Mechanics, udforsker forskellige nanomater
Forskere udvikler sensorer, der registrerer menneskelige biomarkører og giftig gasEt forskningshold fra Penn State, ledet af Huanyu Larry Cheng, Dorothy Quiggle Karriereudviklingsprofessor i Penn State Department of Engineering Science and Mechanics, udforsker forskellige nanomater
- Kontinuerlig åndbar metal-organisk ramme med gæsteselektivitet
- Hvad er de mest aktive familiemetaller?
- Hvad er skalaen for på et termometer?
- Hvilket fossilt brændstof brænder de hotteste, hvilket gør det mest effektivt til elektricitet?
- Hvor mange meter er der i 90 tommer?
- Den økonomiske struktur for førskoleundervisning kræver en revision for at gøre den tilgængelig…


