Hvordan er koncentrationerne af hydrogenioner og hydroxid relateret i en vandig opløsning.?
kW =[H+] [OH-] =1,0 x 10^-14 ved 25 ° C
Her er hvad det betyder:
* neutral opløsning: I en neutral opløsning er koncentrationerne af H+ og OH- ens. Dette sker, når begge er 1,0 x 10^-7 M.
* sur opløsning: I en sur opløsning er koncentrationen af H+ større end koncentrationen af OH-. Dette betyder [H+]> 1,0 x 10^-7 m og [OH-] <1,0 x 10^-7 M.
* Grundlæggende løsning: I en grundlæggende opløsning er koncentrationen af OH- større end koncentrationen af H+. Dette betyder [OH-]> 1,0 x 10^-7 m og [H+] <1,0 x 10^-7 M.
Nøglepunkter:
* Produktet af [H+] og [OH-] er altid lig med KW, selvom opløsningen er sur eller grundlæggende.
* PH -skalaen, der måler surhed/grundlæggende, er relateret til koncentrationen af H+:
* ph =-log [H+]
* Nedre pH -værdier indikerer højere surhedsgrad (mere H+).
* Højere pH-værdier indikerer højere grundlæggende (mere OH-).
Eksempel:
Hvis koncentrationen af H+ i en opløsning er 1,0 x 10^-5 m, kan koncentrationen af OH- beregnes ved hjælp af KW:
[Oh-] =kW / [H+] =(1,0 x 10^-14) / (1,0 x 10^-5) =1,0 x 10^-9 m
 Varme artikler
Varme artikler
-
 Fremtiden ser lys ud for uendeligt genanvendeligt plastikBrett Helms, forgrunden, afbilledet på arbejde i Molecular Foundry i 2019. Kredit:Thor Swift/Berkeley Lab Plast er en del af næsten alle produkter, vi bruger til daglig. Den gennemsnitlige person
Fremtiden ser lys ud for uendeligt genanvendeligt plastikBrett Helms, forgrunden, afbilledet på arbejde i Molecular Foundry i 2019. Kredit:Thor Swift/Berkeley Lab Plast er en del af næsten alle produkter, vi bruger til daglig. Den gennemsnitlige person -
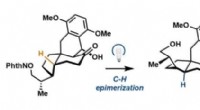 Konkret syntese af pleurotin udvikletEn photoredox radikal epimerisering genererer det tetracykliske skelet af pleurotin. Kredit:Sorensen Lab Fra kemikernes perspektiv er pleurotin et spændende molekyle. Der er stærke beviser for uud
Konkret syntese af pleurotin udvikletEn photoredox radikal epimerisering genererer det tetracykliske skelet af pleurotin. Kredit:Sorensen Lab Fra kemikernes perspektiv er pleurotin et spændende molekyle. Der er stærke beviser for uud -
 Kemisk proces nedbryder lignin og gør birketræ til brugbare kemiske produkterDette billede viser den kemiske reaktor, der blev brugt i undersøgelsen til at spalte træ til træmasse og ligninolie. Kredit:KU Leuven Et team af forskere tilknyttet flere institutioner i Belgien
Kemisk proces nedbryder lignin og gør birketræ til brugbare kemiske produkterDette billede viser den kemiske reaktor, der blev brugt i undersøgelsen til at spalte træ til træmasse og ligninolie. Kredit:KU Leuven Et team af forskere tilknyttet flere institutioner i Belgien -
 Voks på, smelte afForskere fra Drexel University, Purdue University og Oregon State University har opdaget, at tilsætning af paraffinolie til blandingen til vejbeton kan give den evnen til at smelte is og sne, når temp
Voks på, smelte afForskere fra Drexel University, Purdue University og Oregon State University har opdaget, at tilsætning af paraffinolie til blandingen til vejbeton kan give den evnen til at smelte is og sne, når temp
- Hvordan hjælper grøn vegetation til at øge mængden af ilt i atmosfæren?
- Hvad er den højeste hastighed, der nogensinde er nået af en raket?
- Kunne de samme laboratorieteknikker, der blev brugt til at fremstille syntetiske perler, være synet…
- Hvorfor skal rør, der bærer dampen til radiator, isoleres?
- Hvorfor anvendes ethanol på 75 procent i RNA -ekstraktion?
- Eksperter fremhæver avancerede satellitdata som et vigtigt værktøj til at tackle klimaændringer


