Slå op udtrykket elektronegativitet og forklar, hvordan kan hjælpe med at bestemme type kemiske bindinger, der findes i en forbindelse?
Elektronegativitet:Nøglen til bindingstype
Elektronegativitet er et mål for et atoms evne til at tiltrække elektroner i en kemisk binding. Det er et værdifuldt værktøj til at forstå arten af kemiske bindinger, især til at forudsige, om en binding vil være ionisk , kovalent , eller et eller andet sted imellem ( polær kovalent ).
Sådan hjælper elektronegativitet:
1. Sammenligning af elektronegativitetsværdier:
* Stor forskel i elektronegativitet: Når to atomer har en stor forskel i elektronegativitet (typisk større end 1,7), vil den mere elektronegative atom kraftigt tiltrække de delte elektroner, hvilket i det væsentlige "stjæler" dem fra det mindre elektronegative atom. Dette resulterer i dannelsen af en ionisk binding , hvor det ene atom bliver positivt ladet (kation), og den anden bliver negativt ladet (anion).
* Lille forskel i elektronegativitet: Når forskellen i elektronegativitet er lille (typisk mindre end 0,5), deles elektronerne mere ligeligt mellem de to atomer. Dette resulterer i en kovalent obligation , hvor atomerne holdes sammen ved deling af elektroner.
* Mellemforskel i elektronegativitet: Hvis forskellen i elektronegativitet falder mellem 0,5 og 1,7, betragtes bindingen polær kovalent . I dette tilfælde deles elektronerne ulige, hvilket fører til en delvis positiv ladning på det mindre elektronegative atom og en delvis negativ ladning på det mere elektronegative atom.
Eksempel:
* NaCl: Natrium (NA) har en elektronegativitet på 0,93, mens klor (CL) har en elektronegativitet på 3,16. Den store forskel (2.23) angiver en ionisk binding . Klor "stjæler" elektronet fra natrium og danner en natriumkation (Na+) og en chloridanion (Cl-).
* H2: Hydrogen (H) har en elektronegativitet på 2,2. Da begge hydrogenatomer har den samme elektronegativitet, er bindingen kovalent med elektronerne, der deles lige.
* H2O: Oxygen (O) har en elektronegativitet på 3,44, mens brint har en elektronegativitet på 2,2. Forskellen (1.24) angiver en polær kovalent binding , med iltatomet, der har en delvis negativ ladning og brintatomerne, der har delvis positive ladninger.
Kortfattet:
Elektronegativitet er et grundlæggende koncept, der giver os mulighed for at forudsige typen af kemisk binding mellem atomer baseret på deres evne til at tiltrække elektroner. Denne forståelse hjælper os med at fortolke egenskaberne ved forbindelser og forudsige deres opførsel i kemiske reaktioner.
 Varme artikler
Varme artikler
-
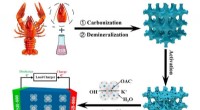 Affald til skat:Krebseskaller til at lagre energiSkematisk diagram over fremstilling af HPCer med tung bioolie (HB) assisteret af krebsskaller. Kredit:Luo Zejun et al Mere end bare en krydret natsnack, krebsen er blevet udstyret med større betyd
Affald til skat:Krebseskaller til at lagre energiSkematisk diagram over fremstilling af HPCer med tung bioolie (HB) assisteret af krebsskaller. Kredit:Luo Zejun et al Mere end bare en krydret natsnack, krebsen er blevet udstyret med større betyd -
 Video:Kemien bag kibbleKredit:The American Chemical Society Har du nogensinde tænkt over, hvor mærkeligt det er, at hunde spiser disse tørre, underligt lugtende stykker mad for hele deres liv og aldrig blive træt af dem
Video:Kemien bag kibbleKredit:The American Chemical Society Har du nogensinde tænkt over, hvor mærkeligt det er, at hunde spiser disse tørre, underligt lugtende stykker mad for hele deres liv og aldrig blive træt af dem -
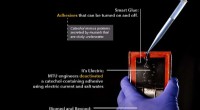 Ingeniører zapper og løsner smart undervandslimTænd og sluk for vedhæftning er det, der gør en lim smart. Det er én ting at gøre dette i det fri og noget helt andet under vand. Inspireret af naturen, katekoler er syntetiske forbindelser, der efter
Ingeniører zapper og løsner smart undervandslimTænd og sluk for vedhæftning er det, der gør en lim smart. Det er én ting at gøre dette i det fri og noget helt andet under vand. Inspireret af naturen, katekoler er syntetiske forbindelser, der efter -
 Ny produktionsteknik til højtydende polymer kunne give bedre rustningEn ny katalysator fremstillet af legerede nanopartikler af guld og palladium kan producere PBO-polymer, som bruges i kropsrustninger og andre højtydende stoffer. Den nye katalysator producerer PBO, de
Ny produktionsteknik til højtydende polymer kunne give bedre rustningEn ny katalysator fremstillet af legerede nanopartikler af guld og palladium kan producere PBO-polymer, som bruges i kropsrustninger og andre højtydende stoffer. Den nye katalysator producerer PBO, de
- Påvirkningstruslen fra asteroiden Apophis kan ikke udelukkes
- Er plodded en hurtig eller langsom?
- NASAs Mars-helikopter foretager anden flyvning
- Heisenberg limit får en meningsfuld opdatering
- Alle celler konverterer den potentielle energi, der findes i fødevaremolekyler til ATP igennem?
- Er det sandt, at der findes en kemiske bindinger mellem atomer for at danne, at mangfoldigheden af …


