Processen med en væske bliver gas?
Der er to hovedmåder, hvor fordampning forekommer:
* Fordampning: Dette er en gradvis proces, der sker ved overfladen af en væske ved enhver temperatur. Molekyler med nok kinetisk energi flugt ud i luften, hvilket efterlader væsken lidt køligere.
* kogning: Dette forekommer, når væsken når sit kogepunkt, som er den temperatur, hvormed damptrykket af væsken er lig med det omgivende atmosfæriske tryk. På dette tidspunkt dannes bobler af damp inden i væsken og stiger til overfladen.
Her er en mere detaljeret forklaring af processen:
1. Varmeabsorption: Væsker absorberer varmeenergi, hvilket øger den kinetiske energi i deres molekyler.
2. Breaking Intermolecular Bonds: Når molekylerne får mere energi, bevæger de sig hurtigere og bryder de intermolekylære kræfter (som hydrogenbinding) og holder dem sammen i flydende tilstand.
3. overgang til gas: Molekylerne slipper ud fra den flydende overflade eller danner bobler i væsken og går ind i gasfasen.
4. udvidelse: I gasfasen har molekylerne meget mere frihed til at bevæge sig og sprede sig, hvilket øger stoffets volumen.
Faktorer, der påvirker fordampning:
* Temperatur: Højere temperaturer fører til hurtigere fordampning, da molekylerne har mere kinetisk energi.
* overfladeareal: Et større overfladeareal af væsken udsætter flere molekyler for luften, hvilket øger fordampningshastigheden.
* atmosfærisk tryk: Nedre atmosfærisk tryk gør det lettere for molekyler at flygte i luften og fremskynde fordampningen.
* Type væske: Forskellige væsker har forskellige kogepunkter og styrker af intermolekylære kræfter, der påvirker deres fordampningshastighed.
Damporisering er en afgørende proces i mange naturlige fænomener og industrielle anvendelser, såsom dannelse af skyer, køleskabsarbejde og raffinering af råolie.
Sidste artikelHvilken type kemiske reaktioner katalyserer kinaser?
Næste artikelHvad er formlen til at finde volumen i kemi?
 Varme artikler
Varme artikler
-
 Grønnere medicinalindustrienDen nye proces er attraktiv, fordi den neutraliserer kulstof, som bidrager til globale klimaforandringer. Kredit:Zelinsky Institute of Organic Chemistry Syntetisering af livreddende lægemidler fra
Grønnere medicinalindustrienDen nye proces er attraktiv, fordi den neutraliserer kulstof, som bidrager til globale klimaforandringer. Kredit:Zelinsky Institute of Organic Chemistry Syntetisering af livreddende lægemidler fra -
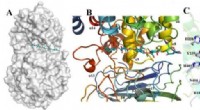 Strukturer i tang kaster lys over bæredygtighedOverfladerepræsentation og substratbindingsrille på Dp0100 Kredit:JI Shiqi Brunalger er ikke bare tang, der flyder i havet og floker svømmernes fødder - de indeholder også en hemmelighed. I sin ce
Strukturer i tang kaster lys over bæredygtighedOverfladerepræsentation og substratbindingsrille på Dp0100 Kredit:JI Shiqi Brunalger er ikke bare tang, der flyder i havet og floker svømmernes fødder - de indeholder også en hemmelighed. I sin ce -
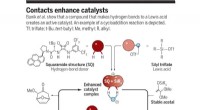 Brug af katalysatorer som en pincet til at vælge en enkelt enantiomer fra et spejlet parBanik et al. viser, at en forbindelse, der laver hydrogenbindinger til en Lewis-syre, danner en aktiv katalysator. Et eksempel på en cycloadditionsreaktion er afbildet. Tf, triflate; t-Bu, tert-butyl;
Brug af katalysatorer som en pincet til at vælge en enkelt enantiomer fra et spejlet parBanik et al. viser, at en forbindelse, der laver hydrogenbindinger til en Lewis-syre, danner en aktiv katalysator. Et eksempel på en cycloadditionsreaktion er afbildet. Tf, triflate; t-Bu, tert-butyl; -
 Det rigtige valg af malm kan skabe lavere emissionerTrine Asklund Larssen har undersøgt, hvordan forskellige slags malm i metalproduktion påvirker energiforbrug og udledning. Kredit:Vincent Canaguier, SINTEF I Norge, metalproduktion tegner sig for
Det rigtige valg af malm kan skabe lavere emissionerTrine Asklund Larssen har undersøgt, hvordan forskellige slags malm i metalproduktion påvirker energiforbrug og udledning. Kredit:Vincent Canaguier, SINTEF I Norge, metalproduktion tegner sig for
- 3-D printede dæk og sko, der reparerer sig selv
- Japan orienterer diplomater om Fukushima nukleare vandproblemer
- Strukturerende sødme:Hvad gør Stevia 200 gange sødere end sukker
- Det bitre brud:Hvad sker der, når forbrugerne dumper deres mærker?
- Hvad er Darwins princip?
- Religiøs tro, der ikke er forbundet med intuition eller rationel tænkning:undersøgelse


