Hvad er arrangementet af ioner i krystaller?
1. Elektrostatiske interaktioner:
* modsatte afgifter tiltrækker: Positivt ladede kationer og negativt ladede anioner tiltrækker hinanden stærkt og danner grundlaget for krystalstrukturen.
* som afgifter afviser: Afvisning mellem ioner med samme ladning forhindrer dem i at besætte tilstødende positioner.
2. Pakningseffektivitet:
* nærmeste pakning: Ioner har en tendens til at arrangere sig på en måde, der maksimerer pakningstætheden, hvilket minimerer tomt rum.
* Koordinationsnummer: Dette henviser til antallet af nærmeste naboioner af modsat ladning omkring en given ion. Koordinationsnummeret påvirkes af de relative størrelser af ionerne.
3. Crystal Gattice:
* enhedscelle: Den mindste gentagne enhed i krystalstrukturen kaldes enhedscellen. Hele krystallen kan bygges op ved at gentage denne enhedscelle i tre dimensioner.
* bravais gitter: Der er 14 forskellige Bravais-gitter, der beskriver alle mulige tredimensionelle arrangementer af punkter.
* rumgrupper: Den fulde symmetri af en krystal er beskrevet af dens rumgruppe, der inkluderer Bravais -gitteret og arrangementet af atomer i enhedscellen.
Almindelige krystalstrukturer:
* enkel kubik: Hver ion er omgivet af seks nærmeste naboer med modsat ladning.
* ansigt-centreret kubik (FCC): Hver ion er omgivet af tolv nærmeste naboer. Dette er en meget almindelig struktur for metaller.
* kropscentreret kubik (BCC): Hver ion er omgivet af otte nærmeste naboer.
* hexagonal tætpakket (HCP): Hver ion er omgivet af tolv nærmeste naboer i et sekskantet arrangement.
Faktorer, der påvirker krystalstruktur:
* ionisk radius: Størrelsen på ionerne spiller en vigtig rolle i bestemmelsen af koordinationsnummeret og den overordnede struktur.
* ionisk ladning: Gladningen af ionerne påvirker styrken af de elektrostatiske interaktioner og dermed stabiliteten af krystalstrukturen.
* Temperatur og tryk: Disse faktorer kan påvirke den relative stabilitet af forskellige krystalstrukturer.
Eksempler:
* NaCl (bordsalt): Har en ansigtscentreret kubisk struktur, hvor hver Na+ -ion er omgivet af seks kloder og vice versa.
* CSCL: Har en simpel kubikstruktur, hvor hver CS+ -ion er omgivet af otte klodser og vice versa.
* diamant: Selvom det ikke er en ionisk krystal, demonstrerer den princippet om nærmeste pakning, hvor hver carbonatom tetraedralt koordineret til fire andre carbonatomer.
At forstå arrangementet af ioner i krystaller er afgørende inden for forskellige områder som materialevidenskab, mineralogi og krystallografi. Det hjælper med at forudsige egenskaber som smeltepunkt, ledningsevne og hårdhed af materialer.
Sidste artikelHvordan måles elektroner i et atom, der er organiseret?
Næste artikelHvad er to kilder til opløste stoffer i havet?
 Varme artikler
Varme artikler
-
 Forskere opnår 4-D trykt materialeForskerne printede deres silikone-baserede prøver ved hjælp af en direkte blæk-skriveproces. Det sammensatte blækmateriale blev ekstruderet ved stuetemperatur fra printerens dyse for at danne træbunke
Forskere opnår 4-D trykt materialeForskerne printede deres silikone-baserede prøver ved hjælp af en direkte blæk-skriveproces. Det sammensatte blækmateriale blev ekstruderet ved stuetemperatur fra printerens dyse for at danne træbunke -
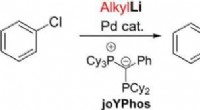 Direkte kobling af arylhalogenider og alkyllithiumforbindelser ved palladiumkatalyseKredit:Wiley Palladiumkatalysatorer hjælper med at syntetisere nøglekemikalier til mange industrier. Imidlertid, direkte reaktion af to grundlæggende reagenser, arylhalogenider og alkyllithiumforb
Direkte kobling af arylhalogenider og alkyllithiumforbindelser ved palladiumkatalyseKredit:Wiley Palladiumkatalysatorer hjælper med at syntetisere nøglekemikalier til mange industrier. Imidlertid, direkte reaktion af to grundlæggende reagenser, arylhalogenider og alkyllithiumforb -
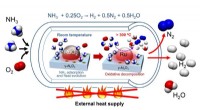 Opdagelse af en let proces til H2 -produktion ved hjælp af ammoniak som bærerH2 -produktion fra ammoniak og ilt udløses ved stuetemperatur uden ekstern varmeindgang. Kredit:Oita University Hydrogen (H2) har tiltrukket sig betydelig opmærksomhed som en ren energikilde, ford
Opdagelse af en let proces til H2 -produktion ved hjælp af ammoniak som bærerH2 -produktion fra ammoniak og ilt udløses ved stuetemperatur uden ekstern varmeindgang. Kredit:Oita University Hydrogen (H2) har tiltrukket sig betydelig opmærksomhed som en ren energikilde, ford -
 Bekæmpelse af kræft ved nulpunktet med designermolekylerEn grafisk repræsentation af det nye molekyle (gule pinde), der interagerer med den glidende klemme (grøn overflade). Kredit:University of Adelaide Et nyt molekyle designet af forskere fra Univers
Bekæmpelse af kræft ved nulpunktet med designermolekylerEn grafisk repræsentation af det nye molekyle (gule pinde), der interagerer med den glidende klemme (grøn overflade). Kredit:University of Adelaide Et nyt molekyle designet af forskere fra Univers
- Hvordan forklarede Suess dannelsen af bjerge?
- Facial motion capture hjælper med at bringe VR -dokumentar til live
- Hvad er funktionerne af kaliumiodidkrystal?
- Står ugifte kvinder over for mangel på partnere på det amerikanske ægteskabsmarked?
- Hvilken planet er den mest fjerne synlige for nøgne øje?
- Norges kvinder bringer tang til kulinariske højder i Europa


