Hvordan måles elektroner i et atom, der er organiseret?
1. Energiniveau (elektronskaller):
* Elektroner findes i forskellige energiniveauer, ofte visualiseret som koncentriske skaller omkring kernen. Disse skaller er nummereret 1, 2, 3 osv., Med højere antal, der indikerer højere energiniveau.
* Elektroner i en lavere skal er tættere på kernen og har lavere energi end dem i højere skaller.
* Det maksimale antal elektroner, der kan besætte en skal, bestemmes af formlen 2n², hvor 'n' er skalnummeret. For eksempel kan den første skal (n =1) indeholde maksimalt 2 elektroner, den anden skal (n =2) kan holde 8, og så videre.
2. Underskaller (orbitaler):
* Inden for hvert energiniveau er der yderligere opdelinger kaldet underskaller. Disse er udpeget af bogstaver:S, P, D og F.
* Hver underskal har en bestemt form og antal orbitaler:
* s subshell: 1 sfærisk orbital (har 2 elektroner)
* p underskal: 3 håndvægteformede orbitaler (holder 6 elektroner)
* D Subshell: 5 komplekse formede orbitaler (holder 10 elektroner)
* f Subshell: 7 Endnu mere komplekse orbitaler (holder 14 elektroner)
* Antallet af underskaller inden for et energiniveau svarer til skalnummeret:
* Shell 1 har kun S -underskalet
* Shell 2 har S- og P -underskaller
* Shell 3 har S-, P- og D -underskaller
* Shell 4 og derover har S, P, D og F -underskaller
3. Orbitals:
* En orbital er et rumområde omkring kernen, hvor der er stor sandsynlighed for at finde en elektron.
* Hver orbital kan maksimalt holde to elektroner, som skal have modsatte spins (spin op og spin ned).
4. Påfyldningsordre (Aufbau -princip og Hunds regel):
* Elektroner udfylder orbitaler i en bestemt rækkefølge efter Aufbau -princippet:
* Elektroner indtaster først de laveste energiniveau.
* Inden for et underskal fylder elektroner orbitaler individuelt, før de parrer sig sammen i den samme orbital (Hunds regel).
Eksempel:
* nitrogen (n) har 7 elektroner:
* De to første elektroner går ind i 1'erne orbital.
* De næste to går ind i 2'erne Orbital.
* De resterende tre elektroner går ind i 2p orbitaler, en elektron i hver orbital inden et par par op.
Nøglekoncepter:
* kvantetal: Disse tal beskriver tilstanden af et elektron og inkluderer det vigtigste kvantetal (N), det azimuthale kvantetal (L), det magnetiske kvantetal (ML) og spin -kvantenummeret (MS).
* Elektronkonfiguration: Denne notation opsummerer arrangementet af elektroner i et atom, der angiver de besatte skaller, underskaller og orbitaler.
At forstå organiseringen af elektroner inden for et atom er afgørende for at forklare den kemiske opførsel af elementer, binding og dannelsen af molekyler.
 Varme artikler
Varme artikler
-
 Varmebehandling giver præcis kontrol over katalytisk aktivitet af metalsulfidnanopartiklerDette scanningselektronmikroskopbillede (forstørrelse x100, 000) viser overfladen af et porøst nikkelskum, der er krydret med katalytiske nanopartikler af koboltsulfid og nikkelsulfid. Kredit:A*STAR
Varmebehandling giver præcis kontrol over katalytisk aktivitet af metalsulfidnanopartiklerDette scanningselektronmikroskopbillede (forstørrelse x100, 000) viser overfladen af et porøst nikkelskum, der er krydret med katalytiske nanopartikler af koboltsulfid og nikkelsulfid. Kredit:A*STAR -
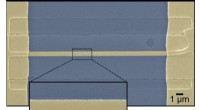 Grænser ingen barriere for termoelektricitetEt scanningselektronmikroskopbillede viser en nanotråd af en krystalguld på et termisk oxid-substrat. Forskere fra Rice University viste, at belastning og defekter i materialet kan ændre dets termoele
Grænser ingen barriere for termoelektricitetEt scanningselektronmikroskopbillede viser en nanotråd af en krystalguld på et termisk oxid-substrat. Forskere fra Rice University viste, at belastning og defekter i materialet kan ændre dets termoele -
 Første detaljerede kig på afgørende enzym fremmer kræftforskningenPetra Fromme er direktør for Biodesign Center for Applied Structural Discovery. Hun er også Regents Professor ved ASUs School of Molecular Sciences. Kredit:Biodesign Institute ved Arizona State Univer
Første detaljerede kig på afgørende enzym fremmer kræftforskningenPetra Fromme er direktør for Biodesign Center for Applied Structural Discovery. Hun er også Regents Professor ved ASUs School of Molecular Sciences. Kredit:Biodesign Institute ved Arizona State Univer -
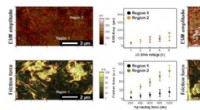 Visualisering af funktionelle komponenter for at karakterisere optimale kompositelektroderAFM -billeder af (a, c) prøver A og (b, d) B. (a, b) Topografiske højdebilleder og (c, d) friktionskraftbilleder, henholdsvis. Alle billeder blev optaget med en spidsbelastningskraft på 400 nN. Røde l
Visualisering af funktionelle komponenter for at karakterisere optimale kompositelektroderAFM -billeder af (a, c) prøver A og (b, d) B. (a, b) Topografiske højdebilleder og (c, d) friktionskraftbilleder, henholdsvis. Alle billeder blev optaget med en spidsbelastningskraft på 400 nN. Røde l
- Var landing på måne sand?
- Hvilke atomer er i ozongas?
- Hvad er fossile beviser?
- Nyt effektivt og sikkert svampedræbende middel isoleret fra havsprøjtmikrobiom
- Hvordan hjælper solseil med at få folk til at fortælle tiden, før der var ure?
- Hvilken type kemisk reaktion er således kulstofforbrændinger i luft til dannelse af CO2?


