Hvor mange elektroner kan gå i det første sekund og tredje skal af et atom?
* første skal (n =1): Den første skal kan indeholde maksimalt 2 elektroner .
* anden skal (n =2): Den anden skal kan indeholde maksimalt 8 elektroner .
* tredje skal (n =3): Den tredje skal kan indeholde maksimalt 18 elektroner .
Forklaring:
Antallet af elektroner, der kan besætte en skal, bestemmes af følgende:
* hovedkantenummer (n): Dette tal repræsenterer skallenes energiniveau. Jo højere 'n' værdi, jo højere er energiniveauet.
* underskaller: Inden for hver skal er der underskaller (S, P, D, F) med forskellige former og energiniveau.
* orbitaler: Hvert underskal indeholder orbitaler, som er regioner af rum, hvor elektroner sandsynligvis findes. Hver orbital kan indeholde maksimalt 2 elektroner.
Her er en sammenbrud for de første tre skaller:
* shell 1 (n =1): Har kun et underskal, 's' underskalet, der indeholder 1 orbital. Så det kan maksimalt indeholde 2 elektroner (1 orbital x 2 elektroner pr. Orbital =2 elektroner).
* shell 2 (n =2): Har to underskaller:'S' (1 orbital) og 'P' (3 orbitaler). Dette giver i alt 4 orbitaler (1 + 3 =4). Derfor kan det maksimalt indeholde 8 elektroner (4 orbitaler x 2 elektroner pr. Orbital =8 elektroner).
* shell 3 (n =3): Har tre underskaller:'S' (1 orbital), 'P' (3 orbitaler) og 'D' (5 orbitaler). Dette giver i alt 9 orbitaler (1 + 3 + 5 =9). Derfor kan det maksimalt indeholde 18 elektroner (9 orbitaler x 2 elektroner pr. Orbital =18 elektroner).
 Varme artikler
Varme artikler
-
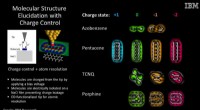 Forskere afbilder molekyler, når de ændrer ladningstilstand for første gangKredit:IBM Et team af forskere fra IBM Research-Zurich, ExxonMobil Research and Engineering Company og Universidade de Santiago de Compostela har, for første gang, afbildede molekyler, når de ændr
Forskere afbilder molekyler, når de ændrer ladningstilstand for første gangKredit:IBM Et team af forskere fra IBM Research-Zurich, ExxonMobil Research and Engineering Company og Universidade de Santiago de Compostela har, for første gang, afbildede molekyler, når de ændr -
 Svampeproduceret pigment viser løfte som halvledermaterialeKredit:Oregon State University Forskere ved Oregon State University ser på et meget holdbart organisk pigment, brugt af mennesker i kunstværker i hundredvis af år, som en lovende mulighed som halv
Svampeproduceret pigment viser løfte som halvledermaterialeKredit:Oregon State University Forskere ved Oregon State University ser på et meget holdbart organisk pigment, brugt af mennesker i kunstværker i hundredvis af år, som en lovende mulighed som halv -
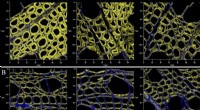 Kvantificering af ændringer i overfladekemi af træplanter under mikrobiel gæringORNL -forskere brugte sofistikerede laserscanningsteknikker til at sammenligne nedbrydningen af fermenteret populær (B) sammenlignet med ugæret populær (A), som de kvantificerede, for første gang, k
Kvantificering af ændringer i overfladekemi af træplanter under mikrobiel gæringORNL -forskere brugte sofistikerede laserscanningsteknikker til at sammenligne nedbrydningen af fermenteret populær (B) sammenlignet med ugæret populær (A), som de kvantificerede, for første gang, k -
 En mere sikker måde for politiet at teste narkotikabeviser påKredit:CC0 Public Domain Forskere har demonstreret en måde, hvorpå politiet hurtigt og sikkert kan teste, om en baggie eller anden pakke indeholder ulovlige stoffer uden at skulle håndtere noget m
En mere sikker måde for politiet at teste narkotikabeviser påKredit:CC0 Public Domain Forskere har demonstreret en måde, hvorpå politiet hurtigt og sikkert kan teste, om en baggie eller anden pakke indeholder ulovlige stoffer uden at skulle håndtere noget m
- Hvordan slår du tyngdekraften til at starte en raket?
- Hvordan påvirker modstand et kredsløb?
- Undersøgelse finder store fordele ved at omfavne sikkerhedsteknologi til køretøjer
- Team udvikler kunstige celler til at studere molekylær trængsel og genekspression
- Hvilke egenskaber har ikke -metaller til fælles?
- Tongzi hominider er potentielt en ny menneskelig forfader i Asien


