Hvorfor betragtes gas som flydende?
* de kan flyde: I modsætning til faste stoffer har gasser ingen fast form og kan let flyde og ændre form under påvirkning af eksterne kræfter. Dette skyldes de svage intermolekylære kræfter mellem gasmolekyler, så de kan bevæge sig frit forbi hinanden.
* de kan tage formen på deres beholder: Gasmolekyler spreder sig for at fylde enhver beholder, de er placeret i, og påtager sig beholderens form.
* de kan komprimeres: I modsætning til faste stoffer er molekylerne i gasser meget længere fra hinanden. Dette muliggør komprimering ved at reducere mellemrummet mellem molekylerne og øge densiteten.
Her er en mere detaljeret forklaring:
molekylær opførsel: Molekylerne i en gas er i konstant tilfældig bevægelse, der kolliderer med hinanden og containerens vægge. Disse kollisioner skaber pres. Molekylerne er så langt fra hinanden, at de oplever meget svage intermolekylære kræfter.
Fluiddynamik: Principperne for væskedynamik gælder for både væsker og gasser. Disse principper beskæftiger sig med væskernes opførsel under forskellige kræfter, som pres, viskositet og opdrift.
Eksempler: Tænk på, hvordan luft flyder rundt om en flyvinge, eller hvordan vind bevæger sig gennem en skov. Dette er alle eksempler på gas, der opfører sig som en væske.
Kortfattet: Gasser har de karakteristiske egenskaber ved væsker, nemlig evnen til at flyde, tage formen på deres beholder og blive komprimeret. Disse egenskaber stammer fra de svage intermolekylære kræfter og høj kinetisk energi af gasmolekyler, hvilket giver dem mulighed for at bevæge sig frit.
 Varme artikler
Varme artikler
-
 En rhodiumbaseret katalysator til fremstilling af organosilicium ved hjælp af mindre ædle metallerEt billede af hydrosilyleringsreaktionen ved anvendelse af den SiO2-understøttede katalysator bestående af et immobiliseret Rh-kompleks og tertiære aminer, med en omsætning på 260 (venstre) og nærmer
En rhodiumbaseret katalysator til fremstilling af organosilicium ved hjælp af mindre ædle metallerEt billede af hydrosilyleringsreaktionen ved anvendelse af den SiO2-understøttede katalysator bestående af et immobiliseret Rh-kompleks og tertiære aminer, med en omsætning på 260 (venstre) og nærmer -
 Test af de antibakterielle egenskaber af hydrofobe overflader på ISSKredit:European Space Agency Et rør ikke-direktiv gælder både for et Matisse-maleri og dette Matiss-eksperiment om bord på den internationale rumstation. Designet til at teste de antibakterielle
Test af de antibakterielle egenskaber af hydrofobe overflader på ISSKredit:European Space Agency Et rør ikke-direktiv gælder både for et Matisse-maleri og dette Matiss-eksperiment om bord på den internationale rumstation. Designet til at teste de antibakterielle -
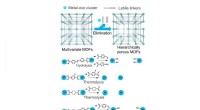 Strategier til at generere større porer i metal-organiske rammerIntroduktion af mesoporer i mikroporøse multivariate MOFer ved selektivt at fjerne labile linkere gennem hydrolyse, termolyse og ozonolyse. Gengivet fra Chem. Soc. Rev., 2019, 48, 4823-4853 med tillad
Strategier til at generere større porer i metal-organiske rammerIntroduktion af mesoporer i mikroporøse multivariate MOFer ved selektivt at fjerne labile linkere gennem hydrolyse, termolyse og ozonolyse. Gengivet fra Chem. Soc. Rev., 2019, 48, 4823-4853 med tillad -
 Udvikling af bæredygtige membraner til fremtidig energiDr. Suzana Nunes (til venstre), KAUST-professor i kemi- og miljøvidenskab og teknik, og Dr. Stefan Chisca (til højre), KAUST-forsker, undersøger en beholder med polymeren, der bruges til at fremstille
Udvikling af bæredygtige membraner til fremtidig energiDr. Suzana Nunes (til venstre), KAUST-professor i kemi- og miljøvidenskab og teknik, og Dr. Stefan Chisca (til højre), KAUST-forsker, undersøger en beholder med polymeren, der bruges til at fremstille
- Hvad er Latitude and Longitude of Missouri?
- Canada forbyder engangsplastik fra 2021
- Planter indeholder et stof kendt som hvad der ikke kan fordøjes af ko?
- Hvad er element i kemi?
- Hvordan genbrug af madaffald til dyrefoder reducerer kulstofemissionerne
- Hvordan vil du fortælle biologi i de virkelige situationer?


