Hvilke ikke -metaller i fast tilstand er dårlige ledere af varme, der har tendens til?
Her er hvorfor:
* svage intermolekylære kræfter: Ikke -metaller har typisk svagere intermolekylære kræfter (som van der Waals -kræfter eller hydrogenbinding) sammenlignet med metaller. Disse kræfter holder atomerne sammen, men de er ikke så stærke som de metalliske bindinger i metaller.
* Mangel på frie elektroner: I modsætning til metaller har ikke -metaller ikke et "hav" af frie elektroner, der let kan bære varmeenergi. Deres elektroner er tæt bundet til atomerne, hvilket gør det vanskeligt for varme at overføre gennem materialet.
* forstyrrede strukturer: Ikke -metaller har ofte mere forstyrrede strukturer sammenlignet med metaller, som har en regelmæssig krystallinsk gitter. Denne lidelse gør det sværere for varme at flyde i en ensartet retning.
Eksempler:
* svovl: Sprød, gult fast stof
* fosfor: Sprød, hvidt eller rødt fast stof
* jod: Sprød, lilla fast stof
* diamant: Ekstremt hårdt, men også sprødt
Bemærk: Der er nogle undtagelser. F.eks. Er grafit (en form for kulstof) en god varmeledning, men den er ikke rigtig sprød og har en lagdelt struktur.
Sidste artikelHvad er trinene til at adskille en blanding?
Næste artikelHvorfor betragtes gas som flydende?
 Varme artikler
Varme artikler
-
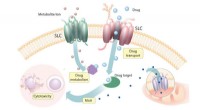 Afdækning af nye forhold mellem SLC'er og cytotoksiske lægemidler i humane cellerSolute Carriers (SLCer) påvirker optagelsen, metabolisme og virkningsmekanisme (MoA) af cytotoksiske lægemidler. Kredit:© Enrico Girardi / CeMM CeMM Forskere har undersøgt, hvordan solute carriers
Afdækning af nye forhold mellem SLC'er og cytotoksiske lægemidler i humane cellerSolute Carriers (SLCer) påvirker optagelsen, metabolisme og virkningsmekanisme (MoA) af cytotoksiske lægemidler. Kredit:© Enrico Girardi / CeMM CeMM Forskere har undersøgt, hvordan solute carriers -
 Nye optiske brintsensorer eliminerer risikoen for gnistdannelseKredit:CC0 Public Domain Brint som et rent, vedvarende alternativ til fossile brændstoffer er en del af en fremtid med bæredygtig energi, og meget allerede her. Imidlertid, dvælende bekymringer om
Nye optiske brintsensorer eliminerer risikoen for gnistdannelseKredit:CC0 Public Domain Brint som et rent, vedvarende alternativ til fossile brændstoffer er en del af en fremtid med bæredygtig energi, og meget allerede her. Imidlertid, dvælende bekymringer om -
 Video:Hvad er evige kemikalier, og holder de evigt?For altid er kemikalier kendt for at være vand-, varme- og oliebestandig, hvilket gør dem nyttige i alt fra regnjakker til brandslukningsskum. Men den kemi, der gør dem så nyttige, får dem også til at
Video:Hvad er evige kemikalier, og holder de evigt?For altid er kemikalier kendt for at være vand-, varme- og oliebestandig, hvilket gør dem nyttige i alt fra regnjakker til brandslukningsskum. Men den kemi, der gør dem så nyttige, får dem også til at -
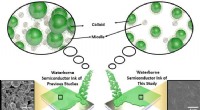 Miljøvenlig vandbåren halvlederblæk ved hjælp af overfladeaktivt stofSammenligning af den vandbårne halvlederblæk i denne undersøgelse og den i de tidligere undersøgelser. Kredit:Daegu Gyeongbuk Institut for Videnskab og Teknologi (DGIST) Et forskerhold fra Energy
Miljøvenlig vandbåren halvlederblæk ved hjælp af overfladeaktivt stofSammenligning af den vandbårne halvlederblæk i denne undersøgelse og den i de tidligere undersøgelser. Kredit:Daegu Gyeongbuk Institut for Videnskab og Teknologi (DGIST) Et forskerhold fra Energy
- Hvilken egenskab ved atmosfære giver teleskoper mulighed for at fremstille billeder himmellegemer?
- Qualcomm sagsøgt af mangeårige partner Arm over højtydende chipteknologi
- Hvor længe siden formede den nebulære hypotese?
- Videnskab giver ny måde at kigge ind i porer
- Hvad giver kroppen mulighed for at køle ned og fjerne affald?
- Egenskaber og opførsel af kæmpen Panda


