Hvad er det punkt, hvor gas- og flydende fase kan skelnes fra hinanden?
Her er en sammenbrud af, hvad det betyder:
* Kritisk temperatur: Ved en specifik temperatur (den kritiske temperatur) forsvinder sondringen mellem væske- og gasfaser. Over denne temperatur kan ingen mængden af tryk tvinge stoffet til at kondensere til en væske.
* kritisk pres: Ved den kritiske temperatur er der et tilsvarende tryk (det kritiske tryk), hvor densiteten af væsken og gasfaserne bliver ens.
på det kritiske punkt:
* Stoffet findes i en superkritisk væsketilstand. Denne tilstand har egenskaber ved både væsker og gasser.
* Menisken mellem flydende og gasfaser forsvinder. Dette skyldes, at væsken og gassen i det væsentlige er blevet en fase.
Eksempel:
Vand har et kritisk punkt ved 374 ° C (647 K) og 22.064 MPa. Over denne temperatur og tryk findes vand som en superkritisk væske.
Betydning af det kritiske punkt:
* Kemiske reaktioner: Superkritiske væsker kan fungere som opløsningsmidler og have unikke egenskaber, der kan anvendes i forskellige kemiske processer.
* ekstraktion: Superkritiske væsker bruges i forskellige industrier som fødevareforarbejdning (afkafinering), farmaceutiske stoffer og miljømæssig sanering.
Fortæl mig, hvis du gerne vil udforske nogen af disse aspekter mere detaljeret!
Sidste artikelHvordan er atomer og elementer forskellige?
Næste artikelHvad er former for kemi?
 Varme artikler
Varme artikler
-
 Ny genetisk metode forbedrer enzymets effektivitetGregg Beckham (til venstre), Christopher Johnson, og Jeffery Linger er medforfattere af en ny forskerartikel, der beskriver, hvordan de forbedrede effektiviteten af et enzym ved nedbrydning af bioma
Ny genetisk metode forbedrer enzymets effektivitetGregg Beckham (til venstre), Christopher Johnson, og Jeffery Linger er medforfattere af en ny forskerartikel, der beskriver, hvordan de forbedrede effektiviteten af et enzym ved nedbrydning af bioma -
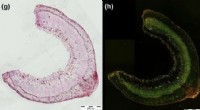 Selvhelbredende materialer inspireret af planterTværsnit af en Linum Drakkar stilk med et 26 dage gammelt sår parallelt med fibrene. Kredit:Cloé Paul-Victor, Albert-Ludwigs-Universitat Freiburg Forskere ved EPFLs Laboratory for Processing of Ad
Selvhelbredende materialer inspireret af planterTværsnit af en Linum Drakkar stilk med et 26 dage gammelt sår parallelt med fibrene. Kredit:Cloé Paul-Victor, Albert-Ludwigs-Universitat Freiburg Forskere ved EPFLs Laboratory for Processing of Ad -
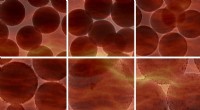 Hydrogenering uden brint:Effektiv katalyse i en stabil emulsionsgelKredit:Transmission Electron Microscope (TEM) billeder af Dele Peter Fapojuwo, Universitetet i Johannesburg. Grafisk design af Therese van Wyk, Universitetet i Johannesburg. UJ-forskere tager et n
Hydrogenering uden brint:Effektiv katalyse i en stabil emulsionsgelKredit:Transmission Electron Microscope (TEM) billeder af Dele Peter Fapojuwo, Universitetet i Johannesburg. Grafisk design af Therese van Wyk, Universitetet i Johannesburg. UJ-forskere tager et n -
 Ingeniører udvikler opskrifter til dramatisk at styrke kropsrustningenEt nærbillede af borkarbidkrystaller Kredit:Texas A&M University College of Engineering Ifølge gammel viden, Djengis Khan instruerede sine ryttere til at bære silkeveste under deres rustning for b
Ingeniører udvikler opskrifter til dramatisk at styrke kropsrustningenEt nærbillede af borkarbidkrystaller Kredit:Texas A&M University College of Engineering Ifølge gammel viden, Djengis Khan instruerede sine ryttere til at bære silkeveste under deres rustning for b
- Kvantekemi på kvantecomputere
- Hvor mange ounces i en og en halv gram?
- Hvad ville der ske med opløseligheden af en gas i vand, hvis volumen blev reduceret, men forblev …
- Det globale overfladeareal for floder og vandløb er 45 procent højere end tidligere antaget
- Hvad kaldes bevægelse af en kropsdel mod den hovedakse, der kaldes?
- At vende en arkæologisk praksis på hovedet


