Gælder begrebet temperatur for et enkelt molekyle?
* Temperatur er en makroskopisk egenskab: Temperaturen er et mål for den gennemsnitlige kinetiske energi for partiklerne i et system. Dette betyder, at det beskriver den kollektive bevægelse af mange partikler, ikke kun en.
* enkeltmolekyler har kinetisk energi: Mens et enkelt molekyle kan have kinetisk energi, har det ikke en temperatur på samme måde som et makroskopisk system gør.
* udsving i kinetisk energi: Et enkelt molekyls kinetiske energi svinger konstant på grund af kollisioner og interaktioner med dens omgivelser. Disse udsving er for hurtige og tilfældige til at definere en konsekvent "temperatur" for selve molekylet.
Analogi: Forestil dig, at du har en enkelt mønt. Du kan vende det, og det vil lande hoveder eller haler. Kan du tildele en "sandsynlighed" til denne enkelt flip? Ikke rigtig. Sandsynlighed er et mål for sandsynligheden for en begivenhed, der forekommer i mange forsøg (flips). Tilsvarende er temperaturen et mål for den gennemsnitlige energi for mange molekyler, ikke en enkelt.
Vi kan dog tale om "temperaturen" på et enkelt molekyle i en bestemt kontekst:
* Statistisk mekanik: Inden for statistisk mekanik kan vi bruge Boltzmann -distributionen til at beregne sandsynligheden for, at et enkelt molekyle har en bestemt energi. Denne sandsynlighedsfordeling kan bruges til at definere en "temperatur" for molekylet, men den beskrives mere nøjagtigt som dens "energitilstand" snarere end dens temperatur.
Konklusion: Mens et enkelt molekyle har kinetisk energi, kan vi ikke tildele en temperatur til den i traditionel forstand. Temperatur er en makroskopisk egenskab, der beskriver den gennemsnitlige energi for mange partikler. Vi kan dog bruge statistisk mekanik til at beskrive sandsynligheden for, at et enkelt molekyle har en bestemt energi, som kan relateres til en "temperatur" i en bestemt kontekst.
Sidste artikelHvordan er nogle metaller beskyttet mod kemisk forandring?
Næste artikelEr 3 i en olie en blanding eller en opløsning?
 Varme artikler
Varme artikler
-
 Lysere fleksibel elektroluminescerende film ved at adoptere øjenstruktur fra natlige dyrStruktur og karakteristika af elektroluminescerende anordning ved hjælp af rekursiv reflektionsstruktur. Strukturer (a~e) og betragtningsvinkelkarakteristika (f) af en elektroluminescerende enhed, der
Lysere fleksibel elektroluminescerende film ved at adoptere øjenstruktur fra natlige dyrStruktur og karakteristika af elektroluminescerende anordning ved hjælp af rekursiv reflektionsstruktur. Strukturer (a~e) og betragtningsvinkelkarakteristika (f) af en elektroluminescerende enhed, der -
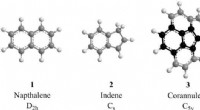 Interstellar kemi:lavtemperaturgasfasedannelse af inden i det interstellare mediumDe enkleste repræsentanter for to-ring PAHer, der bærer to seks-leddede (naphthalen, C10H8; 1) og en seks- sammen med en fem-leddet ring (indene, C9H8; 2). Mens hydrogenabstraktion-vinylacetylen-addit
Interstellar kemi:lavtemperaturgasfasedannelse af inden i det interstellare mediumDe enkleste repræsentanter for to-ring PAHer, der bærer to seks-leddede (naphthalen, C10H8; 1) og en seks- sammen med en fem-leddet ring (indene, C9H8; 2). Mens hydrogenabstraktion-vinylacetylen-addit -
 Måling af COVID-tests følsomhed med nyt materiale fra NISTNIST-materialet indeholder de to RNA-fragmenter vist her. Hvert af disse to fragmenter er omtrent 4, 000 bogstaver langt. NIST-forskere valgte at syntetisere disse særlige fragmenter, fordi de indehol
Måling af COVID-tests følsomhed med nyt materiale fra NISTNIST-materialet indeholder de to RNA-fragmenter vist her. Hvert af disse to fragmenter er omtrent 4, 000 bogstaver langt. NIST-forskere valgte at syntetisere disse særlige fragmenter, fordi de indehol -
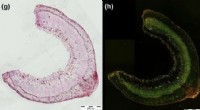 Selvhelbredende materialer inspireret af planterTværsnit af en Linum Drakkar stilk med et 26 dage gammelt sår parallelt med fibrene. Kredit:Cloé Paul-Victor, Albert-Ludwigs-Universitat Freiburg Forskere ved EPFLs Laboratory for Processing of Ad
Selvhelbredende materialer inspireret af planterTværsnit af en Linum Drakkar stilk med et 26 dage gammelt sår parallelt med fibrene. Kredit:Cloé Paul-Victor, Albert-Ludwigs-Universitat Freiburg Forskere ved EPFLs Laboratory for Processing of Ad
- En usandsynlig brug for diamanter
- Spørgsmål og svar:Ny bog udforsker, hvordan valgte stærke mænd svækker demokratiet
- Hvad er en dataforsker?
- Hvad er to egenskaber, der plejede at karakterisere en stjerne?
- Hvordan ændres iltkoncentrationen i forhold til kuldioxid?
- Hvorfor er gastrisk lipase ikke så aktiv?


