Hvad er den fysiske tilstand af mindste alkaner ved stuetemperatur?
Her er hvorfor:
* lav molekylvægt: Disse alkaner har meget lave molekylvægte, hvilket betyder, at de har svage intermolekylære kræfter (van der Waals -kræfter).
* svage intermolekylære kræfter: Svage intermolekylære kræfter gør det lettere for molekylerne at bevæge sig frit og findes som gasser.
Når antallet af carbonatomer i alkankæden øges, øges molekylvægten, og de intermolekylære kræfter bliver stærkere. Dette fører til, at de tungere alkaner er væsker (som propan og butan) eller endda faste stoffer (som pentan og højere) ved stuetemperatur.
 Varme artikler
Varme artikler
-
 Ny teknik åbner nye forskningsmuligheder for nye lægemidler og velsmagende madKredit:Wageningen University Forskere ved Wageningen University har udviklet en ny teknik, der åbner nye muligheder for forskning i nye lægemidler og mere velsmagende, sundere mad. Den nye tilgang
Ny teknik åbner nye forskningsmuligheder for nye lægemidler og velsmagende madKredit:Wageningen University Forskere ved Wageningen University har udviklet en ny teknik, der åbner nye muligheder for forskning i nye lægemidler og mere velsmagende, sundere mad. Den nye tilgang -
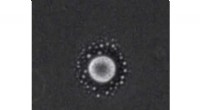 Afblanding ved hjælp af lasere for at lave nye krystallerForskere har formået at adskille to væsker i en blanding ved hjælp af en laser, som de hævder vil føre til nye måder at manipulere stof på og skabe krystaller til industrien. I et papir offentliggjor
Afblanding ved hjælp af lasere for at lave nye krystallerForskere har formået at adskille to væsker i en blanding ved hjælp af en laser, som de hævder vil føre til nye måder at manipulere stof på og skabe krystaller til industrien. I et papir offentliggjor -
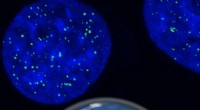 Forskere har sporet en uhåndgribelig sammenfiltret knude af DNAKunstnerens indtryk af i-motivets DNA-struktur inde i celler, sammen med det antistofbaserede værktøj, der bruges til at opdage det. Kredit:Chris Hammang Det er DNA, men ikke som vi kender det. I
Forskere har sporet en uhåndgribelig sammenfiltret knude af DNAKunstnerens indtryk af i-motivets DNA-struktur inde i celler, sammen med det antistofbaserede værktøj, der bruges til at opdage det. Kredit:Chris Hammang Det er DNA, men ikke som vi kender det. I -
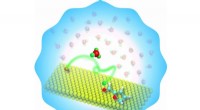 Ingeniører opdager en ny rolle for vand i produktionen af vedvarende brændstofferOU-ingeniører har opdaget en ny tilgang til vandstøttet opgradering af det vedvarende kemikalie, furfural, fordoble eller tredoble konverteringshastigheden. Kredit:University of Oklahoma Universit
Ingeniører opdager en ny rolle for vand i produktionen af vedvarende brændstofferOU-ingeniører har opdaget en ny tilgang til vandstøttet opgradering af det vedvarende kemikalie, furfural, fordoble eller tredoble konverteringshastigheden. Kredit:University of Oklahoma Universit
- Australian Black Summer skovbrande producerede næsten dobbelt så meget CO2 som alle australiere på…
- NASA finder, at Kiko svækkes i det østlige Stillehav
- Hvor meget kobber udvindes fra smeltning?
- Renault afsætter CEO Bollore, i håb om at lukke Ghosn-æraen
- Hvilket udtryk defineres som alle de kemiske reaktioner, der kræver for at opretholde livet?
- Det ydre dække af en dyrecelle?


